「マイクロエンドフェノタイプによる精神病態学の創出」
菅谷 佑樹 (東京大学大学院・医学系研究科・神経生理学教室・助教)
橋本 隆紀 (金沢大学医学系・脳情報病態学(神経精神医学)・准教授)
深澤 有吾 (福井大学・医学部・脳形態機能学領域・教授)
貝淵 弘三 (名古屋大学大学院・医学系研究科・神経情報薬理学・教授)
中澤 敬信 (大阪大学大学院・薬学研究科・特任准教授)
小林 克典 (日本医科大学・薬理学・准教授)
小出 剛 (国立遺伝学研究所・マウス開発研究室・准教授)
深田 優子 (生理学研究所・生体膜研究部門・准教授)
喜多村 和郎 (山梨大学・医学部・生理学講座・教授)
櫻井 武 (京都大学大学院・医学研究科・メディカルイノベーションセンター・准教授)
橋本 均 (大阪大学大学院・薬学研究科・神経薬理学分野・教授)
久保 健一郎 (慶應義塾大学医学部解剖学・講師)
宮川 剛 (藤田保健衛生大学・総合医科学研究所・システム医科学研究部門・教授)
和氣 弘明 (自然科学研究機構・生理学研究所・准教授)
池田 和隆 ((公財)東京都医学総合研究所・依存性薬物プロジェクト・プロジェクトリーダー)
星野 幹雄 (国立研究開発法人国立精神神経医療研究センター・神経研究所・部長)
中山 敬一 (九州大学・生体防御医学研究所・教授)
小泉 修一 (山梨大学・医学部・薬理学講座・教授)
木下 専 (名古屋大学・理学系・教授)
戸田 重誠 (金沢大学・付属病院・講師)
奥野 浩行 (京都大学大学院医学研究科・メディカルイノベーションセンター・特定准教授)
衣斐 督和 (京都府立医科大学・病態分子薬理学・助教)
坂口 昌徳 (筑波大学国際統合睡眠医科学研究機構・准教授)
繁冨 英治 (山梨大学・医学部薬理学・助教)
小林 和人 (福島県立医科大学・医学部・教授)
大隅 典子 (東北大学大学院・医学系研究科・発生発達神経科学分野・教授)
瀬木(西田)恵里 (東京理科大学・基礎工学部・生物工学科・准教授)
大塚 稔久 (山梨大学・大学院総合研究部・医学域基礎医学系・生化学講座第一教室・教授)
南 雅文 (北海道大学・薬学研・教授)
栗生 俊彦 (徳島文理大学・香川薬学部薬理学講座・講師)
![]()
「マイクロエンドフェノタイプによる精神病態学の創出」
真鍋 俊也 (東京大学医科学研究所・教授)
橋本 隆紀 (金沢大学・医学系・准教授)
木下 専 (名古屋大学・理学系・教授)
小林 克典 (日本医科大学・医学部・講師)
小出 剛 (国立遺伝学研究所・准教授)
森 寿 (富山大学大学院・医学薬学研究部(医学)・教授)
戸田 重誠 (金沢大学・付属病院・講師)
小泉 修一 (山梨大学・医学部・薬理学講座・教授)
櫻井 武 (京都大学・医学系研・准教授 )
小林 和人 (福島県立医科大学・医学部・教授)
國井 泰人 (福島県立医科大学・医学部・助教)
田中 謙二 (慶應義塾大学・医学部・特任准教授)
宮川 剛 (藤田保健衛生大学・教授)
佐藤 正晃 (理化学研究所・脳科学総合研究センター・研究員)
McHugh Thomas (理化学研究所・脳科学総合研究センター・チームリーダー)
池田 和隆 (東京都医学総合研究所・依存性薬物プロジェクト・プロジェクトリーダー)
久保 健一郎 (慶應義塾大学・医学部・解剖学・専任講師)
高感度シナプスカルシウムプローブを用いたスパイン内代謝の病態進行の研究
 大倉 正道(埼玉大学・大学院理工学研究科・准教授)
大倉 正道(埼玉大学・大学院理工学研究科・准教授)
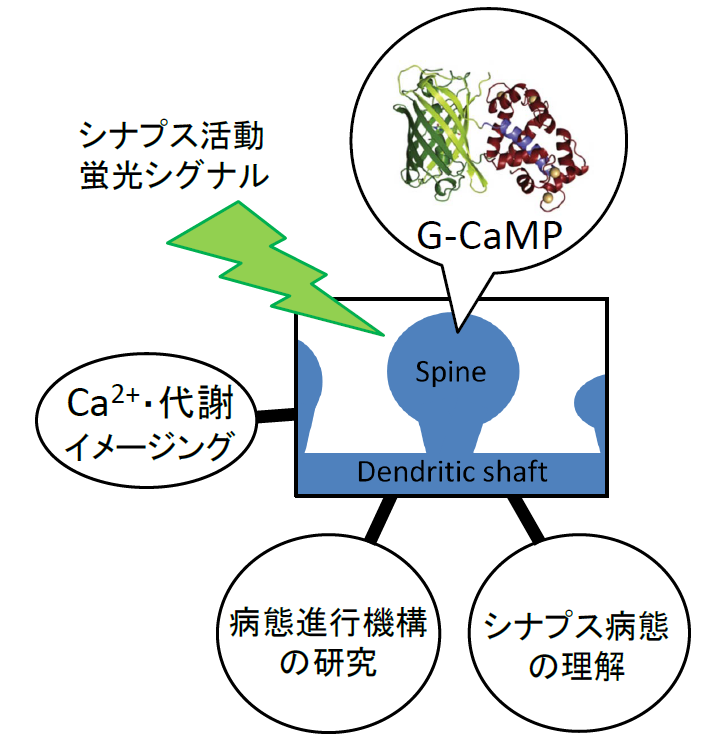
私たちは、脳の情報処理を担う神経回路における個々のシナプスの活動を細胞内カルシウムイオンの濃度変化を指標として目で見えるようにしながら、精神疾患の発現・進行に伴うシナプスの機能変化を明らかにしたいと考えています。単一シナプス活動の検出には高い性能(高感度、高シグナル、高輝度、高速応答性、タンパク質安定性、低副作用)を備えたプローブが必要となります。私たちの強みはイメージングにあります。私たちは蛍光カルシウムプローブタンパク質G-CaMPを開発し、またその後の改良を通じて、生体内の細胞活動の検出を可能にしてきました。私たちが開発したG-CaMPは線虫、ハエ、ゼブラフィッシュ、マウス、ラット、サル等多くのモデル生物で応用されています。最新のG-CaMPでは、マウスやラットの脳スライスにおいてシナプス前細胞の単一発火に応答したシナプス後細胞の個々の樹状突起スパインのカルシウム活動を感度良く検出できることを確認しています。私たちは最新の高性能なプローブを使用できる環境にあります。
本研究では海馬シナプスのCa2+と代謝の変化に注目します。海馬は記憶の形成や想起に関わる脳部位であり、海馬錐体細胞においてグルタミン酸作動性の興奮性シナプスの入力部位である個々の樹状突起スパインが記憶に重要であると考えられています。統合失調症等の一部の精神疾患では進行性の記憶障害が生じますが、そのマイクロ病態として海馬でのスパインの萎縮やスパイン数の減少等が明らかにされてきました。しかしこれらのマイクロ病態がどのように進行しているのかは未だに解明されていません。そこで本研究では、海馬スライスの錐体細胞を標本として用い、進行性の記憶障害を誘発させる薬物の投与や遺伝子の操作によって個々のスパインのCa2+・代謝やシナプス近傍の神経内外環境がどのように変化するのかを明らかにし、記憶障害の発現・進行に関わるマイクロ病態を解明することを目指します。
うつ病における新生神経細胞の役割の解明
 菅谷 佑樹 (東京大学大学院・医学系研究科・神経生理学教室・助教)
菅谷 佑樹 (東京大学大学院・医学系研究科・神経生理学教室・助教)
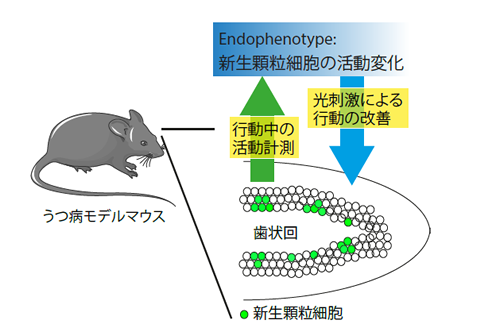
げっ歯類などでは主に脳室の周囲の脳室下層と海馬歯状回顆粒下層において、またヒトでも海馬歯状回顆粒下層と脳室下層、線条体において神経細胞新生が生涯続く。新生した神経細胞は、生理的な状態では記憶の維持、想起、消去に関連していると考えられているが、一方で、さまざまな精神疾患、とくに気分障害や不安障害の病態において重要な役割を果たしている可能性が報告されている。多くのうつ病モデル動物において神経細胞新生が減少し、抗うつ薬の投与によって新生細胞数が回復する。また、動物の不安行動モデルにおいて、放射線照射によって神経細胞新生を抑制すると、抗うつ薬による不安の改善が起きなくなることが報告されている。ヒトにおいてもうつ病患者の死後脳において歯状回の顆粒細胞数の減少や、体積の減少が報告されている。
しかしながら、新生細胞の活動がどのようにうつ病様の行動と関連しており、抗うつ薬の作用の一部がどのようにしてその活動を変化させるのかはいまだ明らかになっていない。その理由は、これまでのマルチユニット記録による細胞活動の記録では成熟顆粒細胞と新生顆粒細胞の活動を明確に区別できなかったからである。
近年、細胞外記録に代わる神経活動の観察方法としてカルシウムイメージングが発展してきている。G-CaMPなどの蛍光カルシウムプローブタンパク質を用いると活動電位による細胞内カルシウム濃度の変化を観察でき、ウイルスベクター技術と組み合わせることで、特定の神経細胞の活動パターンの詳細な解析を行うことが可能となっている。
本研究では海馬歯状回の新生神経細胞の活動をうつ病のマイクロエンドフェノタイプととらえ、新生細胞特異的に蛍光カルシウムプローブタンパク質を発現させて活動を解析し、うつ病モデルにおける新生神経細胞の役割について明らかにすることを目的とする。
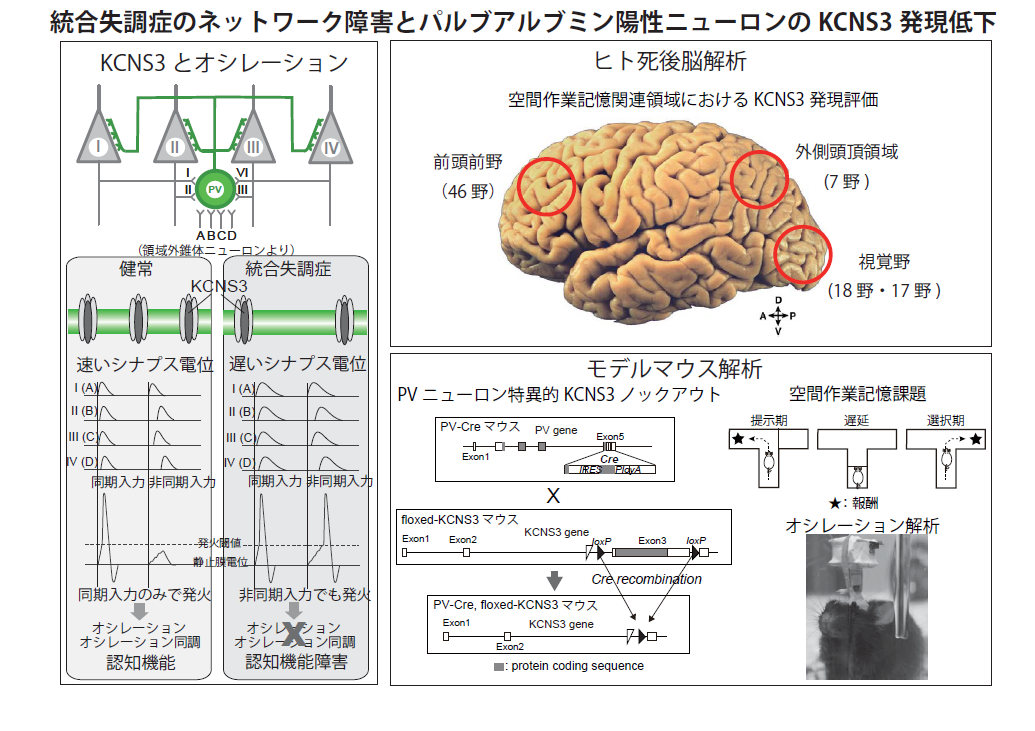
統合失調症のネットワーク障害とパルブアルブミン陽性ニューロンのKCNS3発現低下
 橋本 隆紀 (金沢大学・医学系・脳情報病態学 (神経精神医学)・准教授)
橋本 隆紀 (金沢大学・医学系・脳情報病態学 (神経精神医学)・准教授)
統合失調症では認知機能障害が患者の社会復帰を妨げる大きな要因となっている。認知機能は、複数の脳領域からなるネットワークにより担われ、領域間のコミュニケーションには周期性をもった神経活動(オシレーション)が関与する。大脳皮質では、抑制性介在ニューロンの中でもパルブアルブミン(PV)を発現するサブタイプ(PVニューロン)が、オシレーションの形成や離れた領域間のオシレーションの同調を制御している。KCNS3は、PVニューロンに選択的に発現するカリウムチャンネルサブユニットをコードする遺伝子で、PVニューロンによるオシレーションの形成と領域間の同調を促進する機能を持つことが想定される。我々は、統合失調症の前頭前野において、KCNS3遺伝子の発現低下がPVニューロンで生じていることを前期に見出した。前頭前野は、外側頭頂領域や視覚野とともに、統合失調症における低下が多く報告されている空間作業記憶のネットワークを構成する領域である。本研究では、まず前期から引き続き、この空間作業記憶を担うネットワークを構成する前頭前野、外側頭頂領域、2次視覚野、1次視覚野におけるKCNS3遺伝子発現の変化について、22対の対照者と罹患者の死後脳を用いた解析を継続する。さらに、現在作成中であるPVニューロン特異的KCNS3ノックアウトマウスを完成させ、マウスの空間作業記憶にかかわる前頭前野、内嗅野、海馬においてKCNS3がPVニューロン特異的に発現低下していることを確認する。このノックアウトマウスと対照マウスにT-maze課題を行わせ空間作業記憶を評価すると同時に、前頭前野、内嗅野、海馬におけるオシレーションの形成とこれらの領域間のオシレーションの同調を評価する。これにより、PVニューロンにおけるKCNS3の発現低下がオシレーションの形成または領域間の同調の異常を引き起こし認知機能障害に結びつくことを証明する。
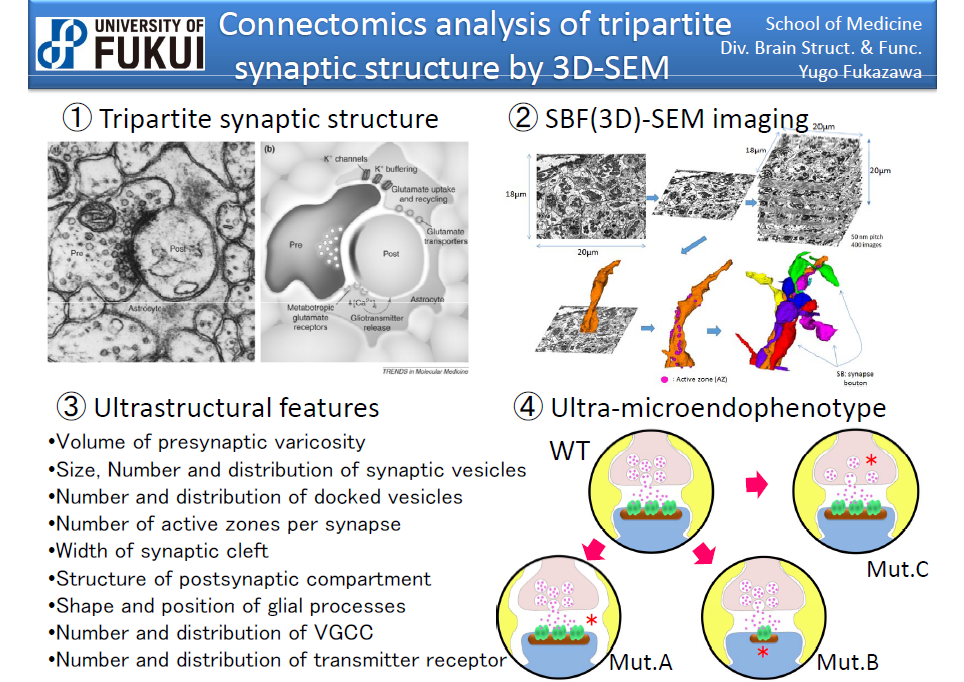
コネクトーム技術を用いた脳内微小構造の標準化と異常解析
 深澤 有吾(福井大学・医学部・脳形態機能学領域・教授)
深澤 有吾(福井大学・医学部・脳形態機能学領域・教授)
ヒトの認知症や精神疾患に類似した行動薬理学的表現型の原因となるマイクロエンドフェノタイプを脳内のシナプス構造、特にシナプス前・シナプス後・シナプス周辺グリア細胞突起が構成するtripartite synapse (TS) 構造の異常と仮定し、野生型と各種遺伝子変異病態モデルマウスの脳各部位のTS構造を定量的な微細構造解析により計測する。計測結果から、各脳領域におけるTS構造の標準化(平均像)と分散(多様性)を抽出することで、形態学的な側面から実験動物の行動薬理学的な特性や異常に関連した脳領域を同定し、動物行動制御の脳内機構や異常を解明する研究基盤を構築することを目的とする。これら解析に近年実用化されたコネクトーム機器/3次元走査型電子顕微鏡(3D-SEM)を用いることで、構造情報の空間精度を向上し、更に自動化による連続断層画像撮影の高速化を図り、これまでに無い次元でのシナプス構造情報を得る。
精神疾患発症脆弱性分子のシグナルネットワークとマイクロエンドフェノタイプ
 貝淵 弘三(名古屋大学大学院・医学系研究科・神経情報薬理学・教授)
貝淵 弘三(名古屋大学大学院・医学系研究科・神経情報薬理学・教授)
統合失調症は思春/青年期から壮年期にかけて発症傾向を示す重篤な精神疾患である。統合失調症の病因は未だ明らかにされていないが、統合失調症患者の死後脳及び脳イメージング解析から統合失調症病因説の1つとして神経発達障害仮説が提唱されている。神経細胞は、動的に形態を変化させることで神経ネットワークを構築し、記憶・学習や情動などの高次機能を制御している。神経細胞の形態変化には、低分子量G蛋白質ファミリーを介した細胞内シグナル伝達による細胞骨格制御が重要な役割を担っていることが知られている。近年、我々は連携研究者ら(名古屋大・医・精神医学:尾崎)と共に統合失調症患者サンプルを用いた高精度DNAコピー数多型(CNV)解析から病因寄与度の高い稀なExonic CNVを同定し、多数の低分子量G蛋白質制御因子をコードする新規精神疾患脆弱性分子(BCR, DOCK4, ARHGAP10, ARHGAP26, RAPGEF1)を見いだした。しかしながら、これらの制御タンパク質群がどのように統合失調症の病態に関与するのかは不明である。本研究で我々は、低分子量G蛋白質制御分子や細胞骨格制御分子に着目し、神経ネットワーク形成やシナプス形態・伝達機能を制御する分子メカニズムを詳細に解析することで、新たなマイクロエンドフェノタイプの創出を目指す。本研究課題にあたり我々は、次の3 つの課題解明を目的とする。
1) 神経発生過程における統合失調症疾患発症脆弱性分子(NDE1, BCR, DOCK4, ARHGAP10, ARHGAP26, RAPGEF1)の機能解析
2) 子宮内電気穿孔法およびウイルス感染法による変異遺伝子発現細胞のin vivo解析
3) 新たな精神疾患モデルマウスを用いた神経病態解析。
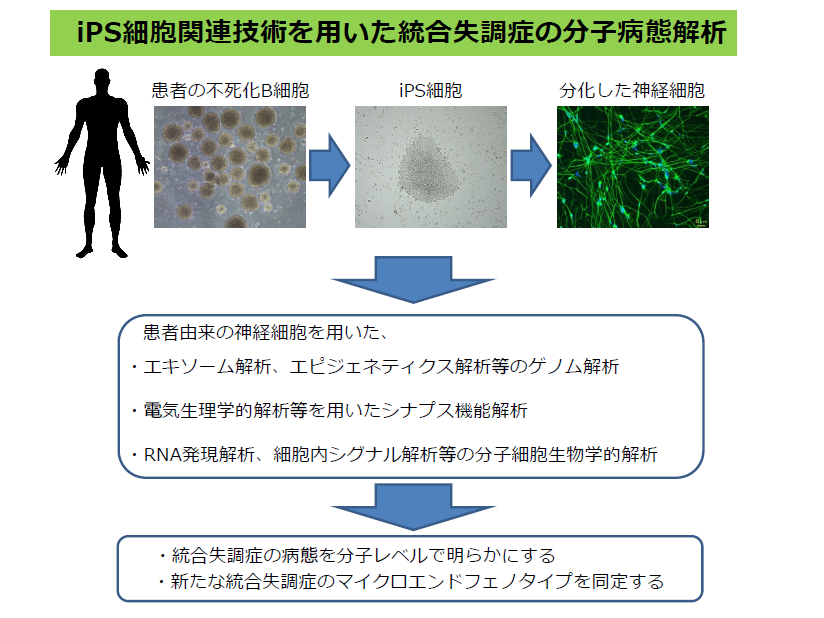
iPS細胞の分化系の技術開発および独自の統合失調症多発家系患者の分子病態解析
 研究代表者:中澤 敬信(大阪大学大学院・薬学研究科・特任准教授)
研究代表者:中澤 敬信(大阪大学大学院・薬学研究科・特任准教授)
 連携研究者:橋本 亮太(大阪大学大学院・連合小児発達学研究科・准教授)
連携研究者:橋本 亮太(大阪大学大学院・連合小児発達学研究科・准教授)
 連携研究者:栗生 俊彦(徳島文理大学・香川薬学部・講師)
連携研究者:栗生 俊彦(徳島文理大学・香川薬学部・講師)
主要な抗精神病薬を用いても効果的ではない患者も多いことから、新たな病因や病態に立脚した統合失調症の創薬が求められています。そのためには、統合失調症の病因・病態の分子レベルの理解が必要であり、患者脳を直接的に対象とした研究が必要であると考えられます。しかし、ヒト脳へのアクセスは著しく困難であるため、分子病態の理解は遅れています。そこで、本研究では、患者由来神経細胞(疾患神経細胞)を直接的に扱うことが可能となるiPS細胞技術を利用した統合失調症の分子病態の解析、およびiPS細胞の神経細胞への分化系の技術基盤の開発を実施します。
具体的には、統合失調症患者の不死化リンパ芽球由来のiPS細胞を介した疾患神経細胞の作製を行い、エキソーム解析、エピジェネティクス解析、RNA発現解析、電気生理解析、分子細胞生物学的解析等の手法を用いて、疾患神経細胞の機能解析を実施します。疾患神経細胞の機能異常に関連した病態のメカニズムを分子レベルで明らかにし、新たな統合失調症のマイクロエンドフェノタイプを同定するとともに、統合失調症の創薬のための基礎データを得ることをめざします。
精神疾患のプレシナプスエンドフェノタイプの形成・維持機構の解析
 小林 克典(日本医科大学・薬理学・准教授)
小林 克典(日本医科大学・薬理学・准教授)
中枢シナプスは精神疾患の発症メカニズムや病態の解明、治療法開発における重要な標的と考えらえている。我々は顕著な精神疾患様の行動異常を示すα-CaMKIIヘテロ欠損マウス(CaMKII+/-)の表現型解析結果に基づき、海馬歯状回の成熟異常が精神疾患のエンドフェノタイプとなる可能性を提唱した。このマウスの最も顕著な機能異常はシナプス伝達のプレシナプス側の変化として観察される(図参照)。歯状回から海馬CA3に投射する苔状線維が形成する興奮性シナプスでは、頻回刺激によって巨大なシナプス促通(プレシナプス性の短期的増強)が見られるが、CaMKII+/-ではこの促通が非常に強く抑制されていた。同様の促通の低下は他の多くの疾患モデルマウスにおいても見られ、これを精神疾患のプレシナプスエンドフェノタイプとして解析してきた。これまでの解析によって、少なくとも一部のモデルマウスにおいてはこのエンドフェノタイプが神経興奮の上昇によって形成、維持されており、神経興奮の抑制によって表現型のレスキュー(シナプスの成熟)が可能であることが示唆された。一方で、神経興奮は神経成熟を促進することも知られており、神経興奮の不足による成熟不全もあり得る。つまり見かけ上同じエンドフェノタイプであってもその形成又は維持機構が正反対の可能性がある。本研究では、生後発達の異なる時期に神経興奮を増強又は抑制したモデルマウスを作製し、プレシナプスエンドフェノタイプの形成・維持機構の多様性を解析する。さらに遺伝子発現パターンのインフォマティクス解析によって、過去に解析したモデルマウスの中から神経興奮異常がエンドフェノタイプ形成・維持に関与する可能性があるモデルを選び、レスキュー実験によってそれを検証する。これらの解析結果に基づいて、バイオマーカーに基づいてプレシナプスエンドフェノタイプの維持機構を推定し、その制御を可能にすることを目差す。
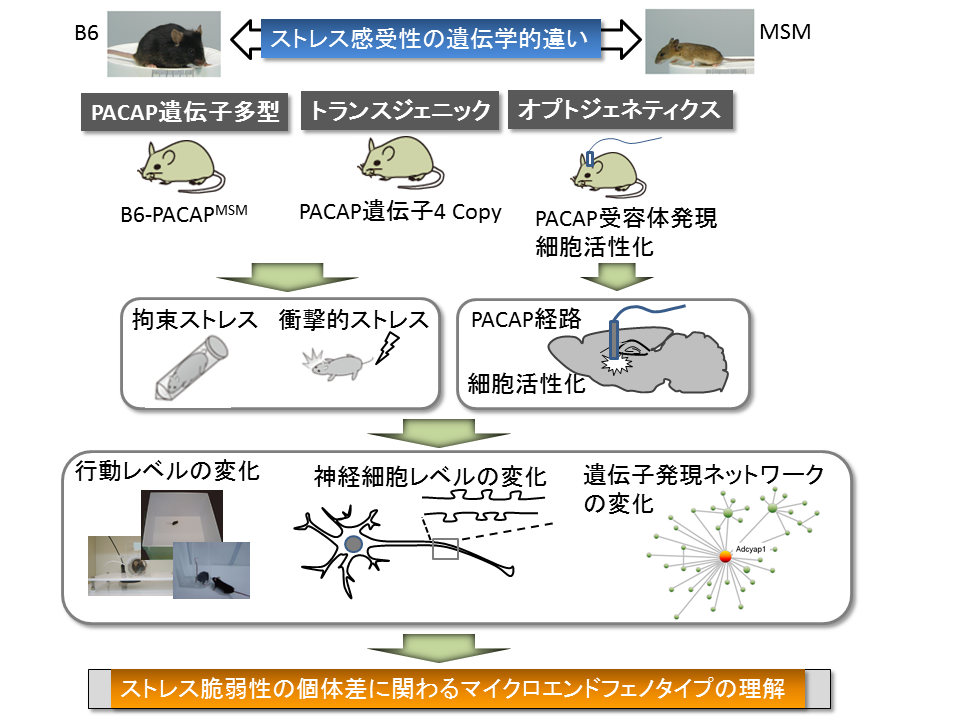
PACAP高発現マウスを用いたPTSD脆弱性のマイクロエンドフェノタイプ
 小出 剛(国立遺伝学研究所・マウス開発研究室・准教授)
小出 剛(国立遺伝学研究所・マウス開発研究室・准教授)
心的外傷後ストレス障害(PTSD)は、事故、災害、犯罪被害などの極度のストレス経験によって引き起こされる疾患で、生涯診断有病率が1%と推定されている。しかし、全ての人が極度のストレス経験の後にPTSDに罹るわけではなく、その発症リスクの個人差には遺伝的要因が関与していることが示されてきている。本研究では、このようなストレス脆弱性の個体差について、遺伝的基盤と、そのマイクロエンドフェノタイプを明らかにすることを目的とする。野生由来マウス系統であるMSMは、他の実験用マウス系統とくらべて極度に高い情動反応性を示す。我々は、遺伝解析を進めた結果、その高い情動性の責任遺伝子としてPACAP遺伝子を同定した。この遺伝子がMSM型となっているマウス(PACAP高発現系統)は、ストレス応答が増強しており、また遺伝子産物であるPACAPペプチド量が増加していることが明らかとなった。神経ペプチドであるPACAPは、自律神経系の興奮制御に強く関わっており、PTSDの症状と関連することが患者の研究により報告されている。このことから本マウスは、ストレス脆弱性やPTSD罹患リスクの個人差メカニズムの探索において、有用なモデル動物になると期待された。
そこで、本研究では、PACAP高発現マウスにおける遺伝子ネットワークの変化や神経回路微細構造の個体差を明らかにすることで、そのマイクロエンドフェノタイプの解明を目指す。さらに、光遺伝学を使った方法により、PACAPの活性化に対して感受性を示す神経回路の解明を目指す。
超解像で可視化するシナプスナノドメインに着目した精神病態表現型解析
 深田 優子(生理学研究所・生体膜研究部門・准教授)
深田 優子(生理学研究所・生体膜研究部門・准教授)
NMDA仮説に代表されるように、統合失調症など精神疾患の病態はシナプス機能異常と密接に関連していると推測されるが、これに基づく定量的なエンドフェノタイプは確立していない。一方、統合失調症様の精神症状を亜急性に生じる免疫介在性脳炎は、患者自己抗体がNMDA受容体やLGI1など脳内シナプスの抗原蛋白質に直接作用して発症する。したがって、免疫介在性脳炎自己抗体が惹起するシナプスの変容は、精神疾患におけるマイクロエンドフェノタイプを反映するものと考えられる。本研究では、申請者らが最近開発した超解像顕微鏡を用いたシナプスナノドメイン可視化法およびグルタミン酸受容体マッピング法により、免疫介在性脳炎自己抗体が惹起するシナプスの構造的、機能的変化を捉え、精神病態のマイクロエンドフェノタイプとして同定する。さらに精神疾患モデル動物や患者死後脳を用いて、同定したマイクロエンドフェノタイプの妥当性を調べると共に、疾患特異性についても明らかにする。
ストレス性精神疾患における扁桃体外側核の病態解明
 森 寿 (富山大学大学院・医学薬学研究部(医学)・分子神経科学講座・教授)
森 寿 (富山大学大学院・医学薬学研究部(医学)・分子神経科学講座・教授)
気分障害、不安障害、心的外傷後ストレス障害(PTSD)等のストレスが関わる精神疾患の生涯有病率は、我が国では20%近くに達しており、国民の健康福祉や経済的観点から克服すべき課題のひとつである。ストレス性精神疾患の原因のひとつとして、扁桃体が担う情動制御の異常が示唆されている。
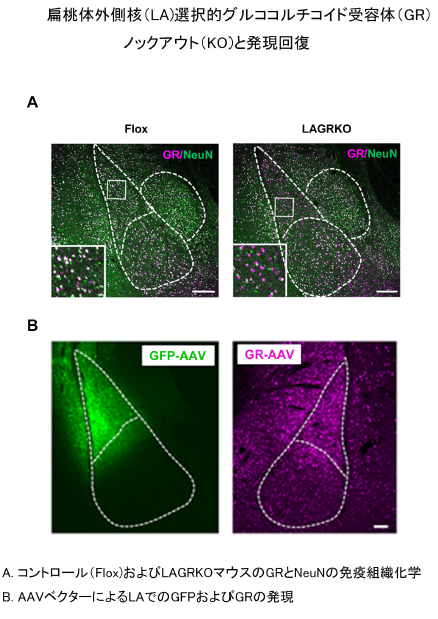
我々は、ストレスホルモンのひとつであるグルココルチコイドの受容体(GR)遺伝子を扁桃体外側核(LA)選択的に欠損させた (LA-GRcKO) マウス系統を独自に作製し、恐怖条件付けを用いた情動学習課題で、1)条件付け回数依存的な記憶獲得の障害、2)ストレス負荷後の恐怖記憶抑制の障害、3)リン酸化CREBの異常、を見いだし、ストレスによる恐怖記憶抑制にLAのGRが関与する可能性を明確にした。
本研究では LA-GRcKOマウスを用いて、恐怖条件付け試験とうつ様症状試験を行い、行動学的表現型と血中ホルモン測定による視床下部-脳下垂体-副腎(HPA)軸機能の変化を明らかにする。また、LA-GRcKOと対照マウスの扁桃体スライスを用いて、1)電気生理学的性質の解析、2)mRNAを抽出しトランスクリプトームの解析、3)抗リン酸化CREB抗体を用いたChIPアッセイを行う。さらに、LA-GRcKOマウスの表現型とGR遺伝子欠損の因果関係を明らかにするために、LAにGR発現ウィルスベクターを導入し、機能回復あるいは恐怖記憶が消去できるか検証する。本研究で、PTSDをはじめとするストレス性の精神疾患や感情障害で見られる情動認知機能障害の分子機構と責任神経回路の性質を明らかにし、また、発現変化の確認できたGRとCREBの標的遺伝子群が、ストレス性精神疾患のあらたなバイオマーカーや薬物治療標的となりうるか評価を行う。
精神病態脳における大規模2光子解析法の開発
 喜多村 和郎(山梨大学・医学部・生理学講座・教授)
喜多村 和郎(山梨大学・医学部・生理学講座・教授)
我々の研究室では、光学イメージング技術を駆使して、大脳皮質および小脳を介する学習や運動制御メカニズムの解明に取り組んでいる。精神疾患は、大脳や小脳を含む多くの脳領域における神経回路の機能障害に起因すると考えられているが、精神病態の中間表現型としての、局所神経回路および脳領域間回路機能の異常について十分に理解されているとはいいがたい。これは、現在の解析技術の限界によるものであると考えられる。本研究では、細胞およびシナプスレベルの活動を広範囲で大規模に解析できる2光子イメージング法を開発することで、局所神経回路や脳領域間回路の活動を高分解能で捉えることを可能にし、精神疾患モデル動物において回路機能異常を同定することで、障害に結びつく回路機構の解明に取り組む。
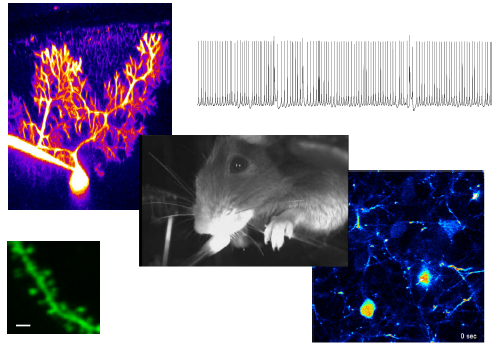
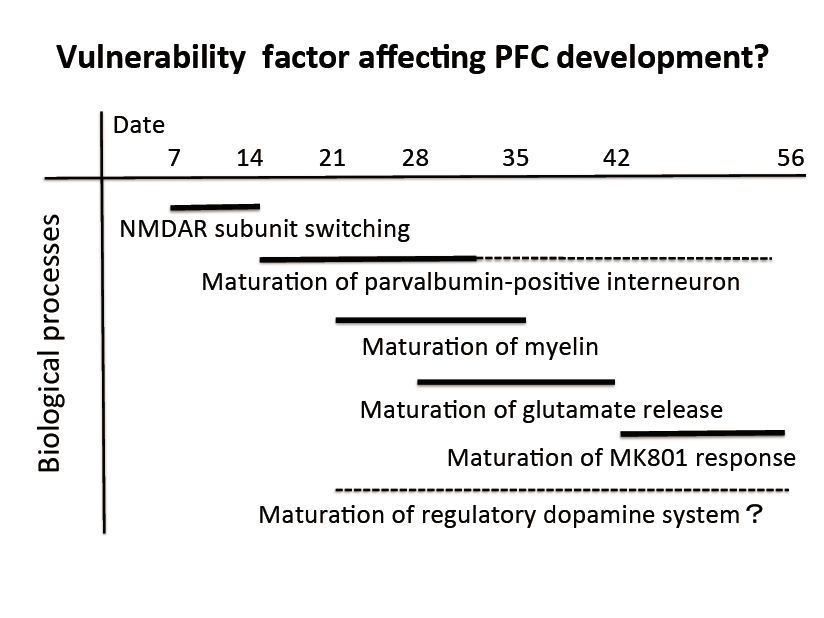
精神疾患に関与する遺伝・環境因子で前頭前野の発達期に現れるマイクロエンドフェノタイプ
 櫻井 武(京都大学大学院・医学研究科・メディカルイノベーションセンター・准教授)
櫻井 武(京都大学大学院・医学研究科・メディカルイノベーションセンター・准教授)
我々の研究室は発達精神障害の病態の分子レベルでの理解を目指している。発達精神障害は自閉症や統合失調症といった疾患であるが、これは脳の発達過程に遺伝因子、環境因子によって引き起こされる変化によって脳のワイヤリングの変調が起こり神経回路の異常を来し、その結果として行動異常を示すと考えられる。近年のヒトゲノム解析から自閉症や統合失調症に関与する遺伝因子の解明が進みそれに基づいたマウスモデルの作製が可能となり、それを利用したヒトの疾患の病態の解析が試みられている。
自閉症や統合失調症の発達精神障害の主症状の一つに認知機能の障害がある。認知機能は前頭前野(PFC)に担われており、PFCの発達に応じて 機能が獲得されていく。PFCの発達は様々な生物学的過程に支えられた回路の形成成熟によると考えられるが、ヒトの場合他の脳領域に比べてPFCの発達には時間がかかり30歳くらいまで続くと考えられている。したがってこの過程は遺伝・環境因子によって影響を受けるタイムウィンドウが長いことが予想され、ヒトのPFCの発達過程がどのように進んでいくかを明らかにしその過程がどのように影響を受けるかの解析が進んでいる。
精神疾患のトランスレーショナルリサーチには先に述べたマウスモデルの果たす役割は大きいが、マウスで認知機能を担うPFCの発達の過程がどうなっているかを明らかにし、それをヒトのそれと対応させてどこが似ていてどこが似ていないのかを明らかにする事が、今後のマウスモデルの解析をヒトの疾患の理解に最大限に活用するのにおいて重要になってくると考えられる。我々はPFCの発達段階にどういった生物学的事象が段階的に起こっていくかを明らかにし、それらの過程が精神疾患に関与すると考えられる遺伝・環境要因によってどのような異常が起こるかをマイクロエンドフェノタイプとして明らかにする事を目標としている。
高精細全脳イメージングによるマイクロ精神病態の探索
 橋本 均(大阪大学大学院・薬学研究科・神経薬理学分野/連合小児発達学研究科附属子どものこころの発達研究センター・教授)
橋本 均(大阪大学大学院・薬学研究科・神経薬理学分野/連合小児発達学研究科附属子どものこころの発達研究センター・教授)
統合失調症やうつ病などの精神疾患は、様々な遺伝因子と環境要因が複雑に相互作用して発症するものと推定されていますが、その分子メカニズムは未だほとんど不明です。精神疾患には脳が関係しますが、ヒトでは脳に直接アクセスすることが困難であるため、ヒト疾患を模倣するモデル動物を用いて研究することが必要です。そのため、私たちは最近、全ての脳領域の細胞を高い解像度でイメージングし、その変化を定量的に捉える解析システムを開発することに成功しました。そこで、本研究課題ではこのシステムを用いて、疾患モデル動物の全脳の形態や活動の変化を解析し、精神疾患のマイクロエンドフェノタイプを見出す研究を実施します。また、そのマイクロエンドフェノタイプをもとに、ヒト疾患における治療効果がある薬を、モデル動物に投与して治療した際の脳内変化を観察し、次に同様な変化を強く起こす新しい薬の探索も目指します。これらにより、疾患の分子メカニズムと治療メカニズムの解明や、新規治療薬の開発に貢献したいと考えています。
これまでの研究により、一回のストレスを受けたマウスでは、様々な脳領域の神経細胞が活性化し、それらにはこれまでに報告がない興味深い脳部位が含まれていること、また長期間のストレスを受けたマウスでは、脳内の神経活動がむしろ低下していることが分かりました。今後さらに、仮説フリーで、システムとしての脳の変化を捉え、その結果をマイクロ精神病態の領域内の連携により検証するとともに、ヒト臨床研究に橋渡しし、脳や精神疾患の分子メカニズムの理解や創薬につなげる研究に取り組んで行きたいと考えています。

高精細全脳イメージング装置
共焦点レーザー顕微鏡、計7軸の電動アクチュエータおよび振動切削装置を用いた順次切断法を用いた装置。高速で高い解像度のイメージングが可能になった。微細な組織構築変化をマイクロエンドフェノタイプとする精神神経疾患の病態解明
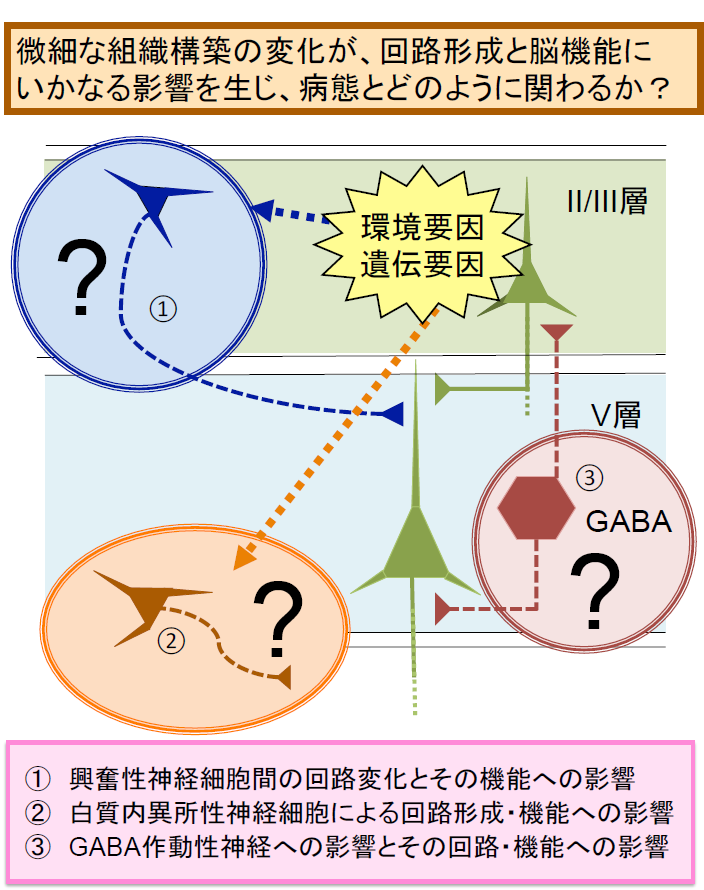
 久保 健一郎(慶應義塾大学医学部解剖学・講師)
久保 健一郎(慶應義塾大学医学部解剖学・講師)
精神神経疾患の死後脳研究において、神経細胞の配向の異常、層構造の乱れ、白質内異所性神経細胞の増加など、微細な組織構築の変化が報告されてきた。これらの所見は統合失調症のみならず、自閉症スペクトラム障害(ASD)や双極性障害でも報告されたことがある。このような微細な組織構築の変化は、すべての患者に見られるわけではないものの、それぞれの疾患における一定のサブポピュレーションの患者脳に存在する可能性がある。このため、微細な組織構築の変化は、統合失調症や自閉症スペクトラム障害(ASD)等の精神神経疾患におけるマイクロエンドフェノタイプの候補の一つとなると考えられる。しかし、微細な組織構築の変化がどのように疾患発症に結びつくのか、その病態的な意義は必ずしも明らかではない。そこで本研究では、それぞれの微細組織構築の変化が、どのような回路網形成の異常に結びつき、また、どのような影響を動物の脳機能や行動に及ぼすのかを解明したいと考えている。特に、精神疾患に関連が強い、海馬や前頭前皮質などに注目して、微細組織構築の変化によって、どのような回路形成の変化が生じ、それが発達過程においてどのように変遷し、さらには成熟後の動物の行動や認知機能に影響を与えるのかを明らかにしたい。また、この微細な組織構築の変化が、他のマイクロエンドフェノタイプ(例えば、GABA作動性(抑制性)神経細胞、シナプス形成・動態、エピジェネティックス、神経細胞分化状態等にみられる変化)とどのように関わるについても明らかにしていきたい。
非定型炎症を伴う精神疾患モデル動物を活用したマイクロ精神病態の同定と分子機序解明
 宮川 剛(藤田保健衛生大学・総合医科学研究所・システム医科学研究部門・教授)
宮川 剛(藤田保健衛生大学・総合医科学研究所・システム医科学研究部門・教授)
私たちは、これまでに170系統以上の遺伝子改変マウスの行動を網羅的に解析し、多数の精神疾患モデルマウスを同定してきました。それらの一部のマウスに共通して、成体であるにもかかわらず海馬歯状回のほぼ全ての神経細胞が未成熟な状態にあるという現象 -非成熟歯状回- が生じていることを世界で初めて報告しました1。非成熟歯状回様の現象は統合失調症や双極性障害の患者の死後脳でも見られることもわかり2、私たちは非成熟歯状回を統合失調症や双極性障害などの精神疾患のエンドフェノタイプ候補の一つとして提唱しています。最近、ひときわ顕著な行動異常パターンと非成熟歯状回を示すマウスとしてSchnurri-2ノックアウト(Shn-2 KO)マウスを同定しました3。 このShn-2 KOマウスは、脳の遺伝子発現パターンが統合失調症患者の死後脳のものと酷似していたほか、抑制性神経細胞マーカーのパルバルブミンや各種オリゴデンドロ サイトマーカーの減少、シータ波・ガンマ波などの脳波異常など統合失調症患者の脳で報告されている多くの特徴を備えており、優れた統合失調症モデルマウス であることがわかりました。さらに、Shn-2 KOマウスを含めた非成熟歯状回を持つマウスや統合失調症患者の脳では、軽度で慢性的な炎症が生じていることが明らかとなり、これが統合失調症の各種のエ ンドフェノタイプの背景にある可能性があります。しかし、軽度の慢性炎症がなぜ生じ、それがどのような脳の異常を引き起こしているのかは未だ明らかではありません。本研究では、脳の軽度慢性炎症によって誘導される神経細胞やグリア細胞の各種の異常を精神疾患のマイクロエンドフェノタイプとして捉え、(1)遺伝的・環境的要因が軽度慢性炎症を引き起こすメカニズムを解明すること、 (2)軽度慢性炎症が原因となって生じるマイクロエンドフェノタイプを同定し制御すること、を目指します。
1. Yamasaki et al. Mol. Brain, 1, 6 (2008).
2. Walton et al. Transl. Psychiatry, 2, e135 (2012).
3. Takao et al. Neuropsychopharmacology, 38, 1409-1425 (2013).
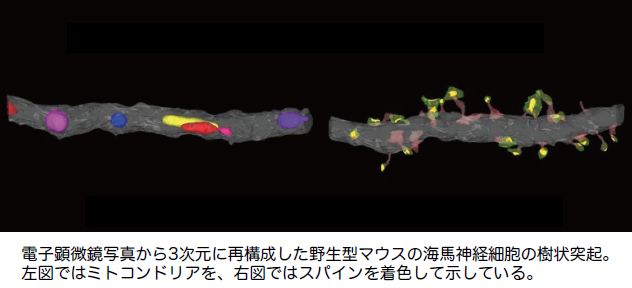
グリア細胞からみる精神疾患
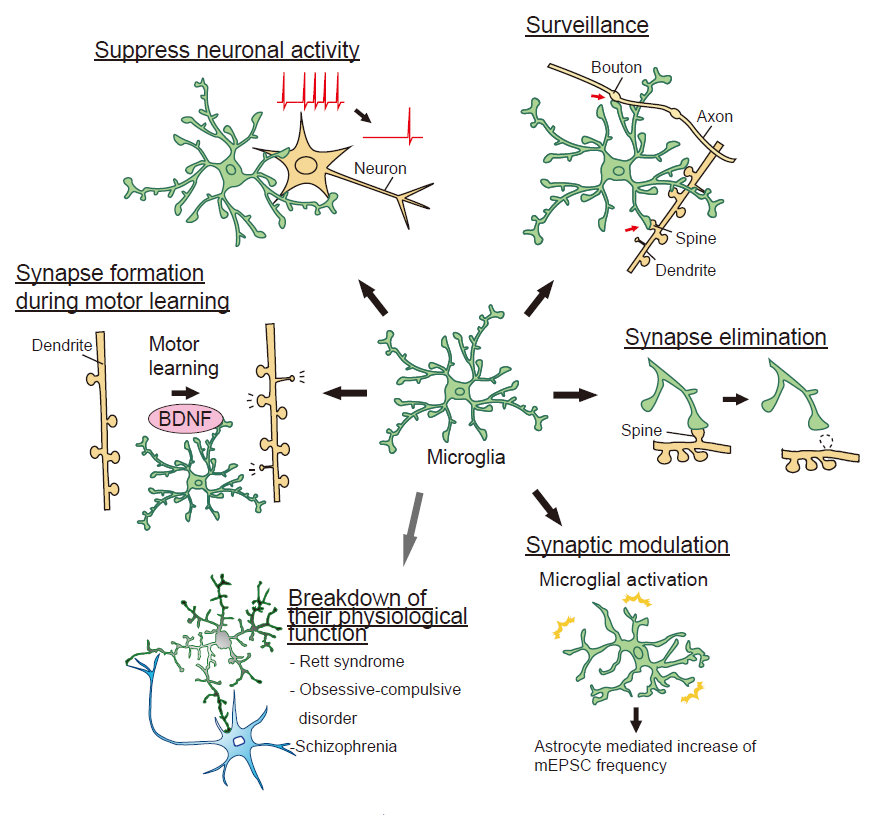
 和氣 弘明(自然科学研究機構・生理学研究所・准教授)
和氣 弘明(自然科学研究機構・生理学研究所・准教授)
ミクログリアは中枢神経系唯一の免疫細胞である。疾患において形態の変化する細胞として着目され、様々な精神・神経疾患で活性化され、神経毒性的、もしくは神経保護的に作用し、疾患の進行に作用するという観点から数多くの研究が進められてきた。近年、2光子顕微鏡をはじめとした新しい光学技術の発達により、グリア細胞の生理的機能が明らかになってきた。なかでもミクログリアは絶えずその突起の伸展・退縮を繰り返していることがわかった。その動きによってミクログリアはシナプスを監視し、その形成・除去に関与し、さらには神経細胞活動に影響することが示された。しかしながら、これらのグリア細胞の生理的機能の破綻によってどのような精神疾患・発達障害が生じるかは明らかではない。本研究では統合失調症モデルを用いて、そのマイクロエンドフェノタイプの理解をグリア細胞から考察するために、グリア細胞の生理的機構の破綻によって生じる変化を抽出し、2光子顕微鏡下でマウスに学習課題を行わせ、抽出された変化が起因となって表出される神経回路基盤の変容、そしてその個体の異常行動との相関を計測する。
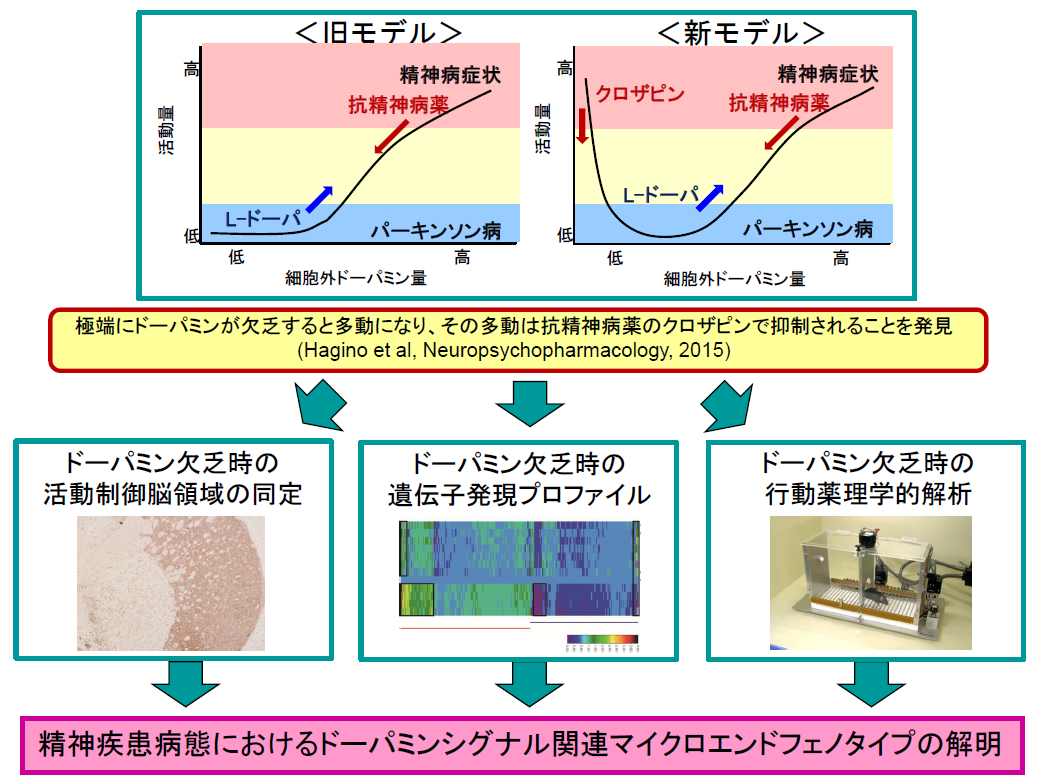
精神疾患病態におけるドーパミンシグナル関連マイクロエンドフェノタイプの解明
 池田 和隆(公益財団法人東京都医学総合研究所・依存性薬物プロジェクト・プロジェクトリーダー )
池田 和隆(公益財団法人東京都医学総合研究所・依存性薬物プロジェクト・プロジェクトリーダー )
ドーパミンは、快情動、人格、注意など主要な精神活動や運動を制御する極めて重要な脳内物質であり、実際、様々な抗精神病薬の全てが、ドーパミンシグナル伝達を修飾する作用を有することや、依存性薬物のほとんどが側坐核におけるドーパミンの放出を引き起こすことが知られている。従って、ドーパミンシグナルの変調は精神疾患病態におけるマイクロエンドフェノタイプであると考えられる。従来、ドーパミン量と活動量は相関すると考えられてきたが、研究代表者らは、ドーパミン欠乏マウスではむしろ活動量が亢進しておりこの亢進が定型抗精神病薬ではなく非定型抗精神病薬によって抑制されるという驚くべき実験結果を得た(Hagino et al, Neuropsychopharmacology, 2015)。ドーパミン欠乏マウスの解析は、ドーパミンシステムの機能解明において画期的な手法である。そこで、ドーパミン欠乏マウスをさらに解析することで、ドーパミンシグナル変調というマイクロエンドフェノタイプが精神活動に与える真の影響を解明できると考え、本研究を着想した。
本研究の具体的な目標は以下である。
1) ドーパミン欠乏時の活動を制御する脳領域を免疫組織化学的に同定する。
2) ドーパミン欠乏時の各種脳領域における遺伝子発現プロファイリングを行い、他の精神疾患モデル動物と比較する。
3) ドーパミン欠乏時の依存性物質および精神科領域薬物の効果を行動薬理学的に解明する。
各種精神疾患のde novo発症に共通に関連する遺伝子の機能解析と病態解明
 星野 幹雄(国立精神神経医療研究センター・神経研究所・部長)
星野 幹雄(国立精神神経医療研究センター・神経研究所・部長)
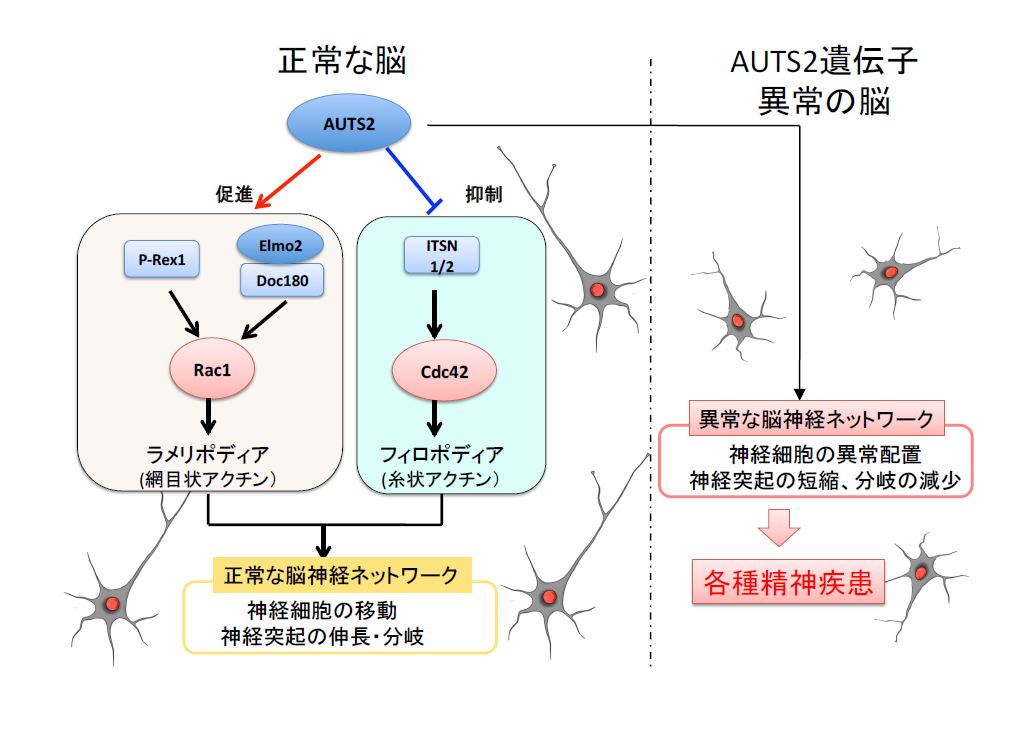
ヒトAUTS2遺伝子は、ASD、統合失調症、てんかん、ID、ADHDなどの幅広い精神疾患患者でde novoのヘテロ遺伝子異常が多数報告されているため、AUTS2はde novo発症の幅広い精神疾患の病理に共通して関連すると考えられている。しかしながら、AUTS2の分子生理機能は全くわかっていなかったため、その病理についてはつい最近まで未解明なままであった。しかし我々は2014年末に、AUTS2蛋白質がRhoファミリーG蛋白質Rac1およびCdc42シグナル伝達系を制御し、アクチン細胞骨格系の再構成を介して、神経細胞移動、神経突起伸長に関与することを報告した。
本研究では今までの研究をさらに進め、すなわち培養細胞や子宮内電気穿孔法、プロテオミクス解析など多角的な解析によって、AUTS2の細胞生物学的、神経発生生物学的機能をより詳細に明らかにする。特に、シナプス形成およびシナプス機能における役割に重点をおき解明する。また、AUTS2遺伝子の様々なタイプのゲノム変異をCRISPR/Cas9システムを用いてマウスゲノム上に導入し、そのマウスを解剖学的、電気生理学的、行動学的に解析する。AUTS2を各種精神疾患のde novo発症に共通に関連するモデル遺伝子として解析することで、各種精神疾患に共通する神経回路の病理基盤と、さらには個々の精神疾患に固有な病理について明らかにする。
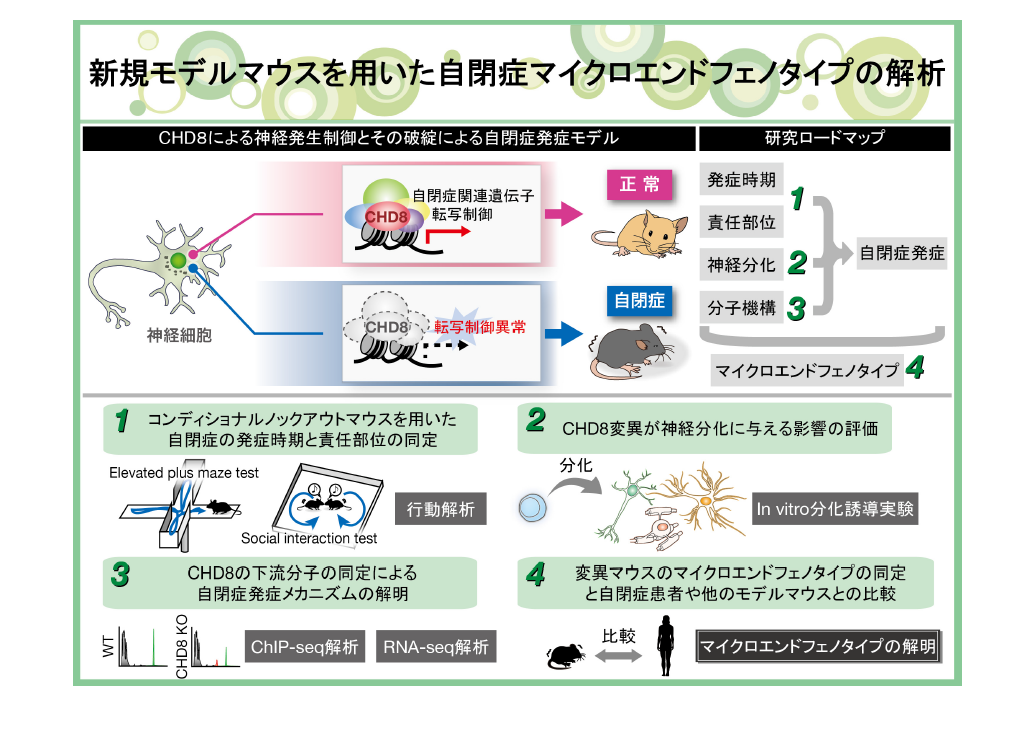
新規モデルマウスを用いた自閉症マイクロエンドフェノタイプの解明
 中山 敬一(九州大学・生体防御医学研究所・教授)
中山 敬一(九州大学・生体防御医学研究所・教授)
自閉症スペクトラム障害は非常に発症頻度の高い神経発達障害であり、その発症メカニズムの解明と治療法の開発が急務である。しかしながら自閉症スペクトラム障害は多様な病態が入り混じった幅広い疾患概念であるため、その病態を忠実に再現するモデル動物の確立は困難である。近年、自閉症家系の大規模エクソーム解析の結果から、最も有力な原因候補遺伝子としてクロマチンリモデリング因子CHD8が同定され、世界中で大きな反響を呼んでいる。そこでわれわれは自閉症患者のCHD8変異を再現したモデルマウスを作製し行動解析を行ったところ、予想通り自閉症様症状を呈することが判明した。われわれはこれまでに、CHD8がp53やβ-カテニンの転写活性を抑制することで発生期の器官形成に重要な役割を果たしていることを明らかにしており、CHD8変異マウスにおける自閉症発症は神経発生過程における転写制御の破綻が原因であると考えられる。そこで、本研究ではわれわれが作製した新規自閉症モデルであるCHD8変異マウスのマイクロエンドフェノタイプを同定することによって自閉症の発症メカニズムを明らかにする。具体的な到達目標としては、(1)コンディショナルノックアウトマウスを用いて、自閉症の発症時期と責任部位を同定する。(2)In vitro分化誘導系を用いて、CHD8の変異が神経分化に与える影響について評価する。(3)網羅的解析によってCHD8の下流分子を同定し、自閉症の発症メカニズムを明らかにする。(4)CHD8変異マウスのマイクロエンドフェノタイプを同定し、自閉症患者や他のモデルマウスと比較検討する。最近の知見では、自閉症スペクトラム障害は二次的に他の精神疾患を発症する原因になる可能性が示唆されており、本研究の遂行によって多様な精神疾患に広く共通した病態解明につながることが期待される。
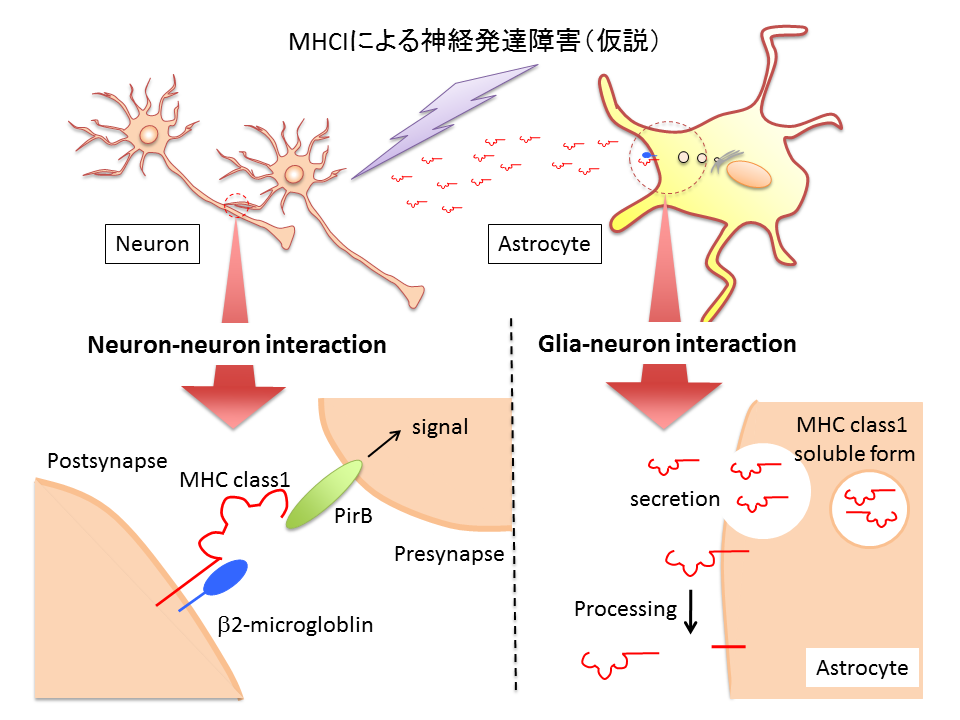
グリア細胞におけるMHCクラスI分子の過剰発現とマイクロエンドフェノタイプ
 山田 清文(名古屋大学医学部附属病院・教授)
山田 清文(名古屋大学医学部附属病院・教授)
主要組織適合遺伝子複合体クラスI分子 (MHCI) は免疫系で重要な役割を果たしているが、脳神経系では神経発達やシナプス可塑性に重要な役割を果たしている。本新学術領域との関連では、神経発達障害との関連性が報告されており、MHCIは統合失調症の遺伝的要因あるいは環境要因に基づく神経発達障害を仲介する分子であると提唱されている。しかし、MHCIの発現変化に伴う脳神経発達あるいは高次脳機能発達の変化についてはほとんど解っていない。
我々は統合失調症の環境要因を考慮した周産期擬似ウイルス感染モデル(polyICモデル)を開発し、周産期の異常免疫応答が神経発達障害を誘発する分子機構について研究を進めてきた。PolyICモデルの神経発達障害の起点はアストロサイトの自然免疫応答であり、本モデルマウスは樹状突起のスパイン数の低下など神経発達障害と統合失調症様の行動異常を示す。一方、PolyICモデルマウスの海馬ではMHCI/H-2D, H-2K の遺伝子発現が増加し、培養アストロサイトをpolyICで刺激するとMHCI/H-2D,H-2K遺伝子が誘導され、培養液中の可溶性MHCI/H-2D (sMHCI/H-2D)が増加することを確認している。本研究ではグリア細胞におけるMHCI分子の過剰発現に関連するマイクロエンドフェノタイプをin vitroおよびin vivoで解析することにより、神経発達障害におけるMHCIの役割を追究する。
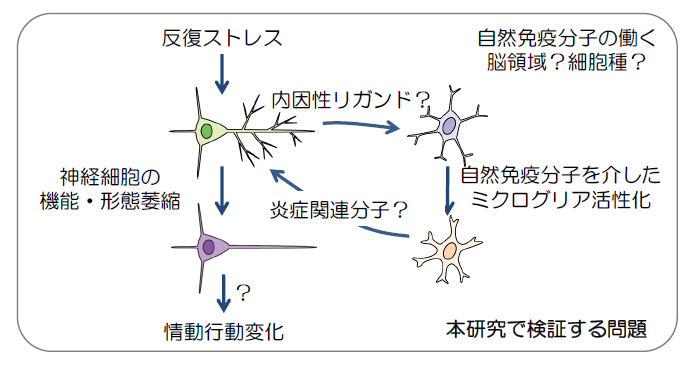
マウス反復ストレスによる情動変容を担う自然免疫関連分子の作用とその活性化機構
 古屋敷 智之(神戸大学大学院・医学研究科・薬理学分野・教授)
古屋敷 智之(神戸大学大学院・医学研究科・薬理学分野・教授)
過度のストレスやストレスの遷延化は、抑うつや不安亢進といった情動変化を引き起こすとともに、うつ病など精神疾患のリスク因子となる。ストレスによる脳機能変化の分子・神経回路基盤には不明な点が多く、ストレスを標的とした精神疾患創薬は確立していない。我々は、マウスの反復社会挫折ストレスモデルを用い、ストレスによる情動変化に炎症関連分子であるプロスタグランジン(PG)E2の受容体EP1とPG合成酵素COX1が必須であること、COX1が脳内ではミクログリアに濃縮して発現し、またストレスによりミクログリアの形態や分子発現が変化することを示してきた。これらの結果から、ストレスにおける神経ミクログリア相互作用の重要性を提唱している。しかしストレスによるミクログリア活性化の役割は確立しておらず、その分子機序もほとんど分かっていない。
自然免疫分子は外来性の微生物のもつ分子パターンを認識するパターン認識受容体として同定されたが、近年では、細胞の損傷やストレスにより内因性のダメージ関連分子が放出され、これが自然免疫分子を介して炎症を惹起することが知られつつある。自然免疫分子はミクログリアを活性化しうることから、第一期公募研究では、マウスの反復社会挫折ストレスモデルにおける自然免疫分子の役割を調べ、ストレスによるミクログリア活性化に自然免疫分子が必須であること、そのミクログリア活性化が情動変化に不可欠であることを示した。第二期公募研究では、ストレスによる情動変化を担う自然免疫分子が働く細胞種や脳領域を確定し、ストレスにより活性化されたミクログリアが神経細胞の機能形態変化を促す分子機序とその情動変化との関連を調べる。さらに、反復ストレスによる情動変化を促す自然免疫分子の活性化因子の同定を試みる。
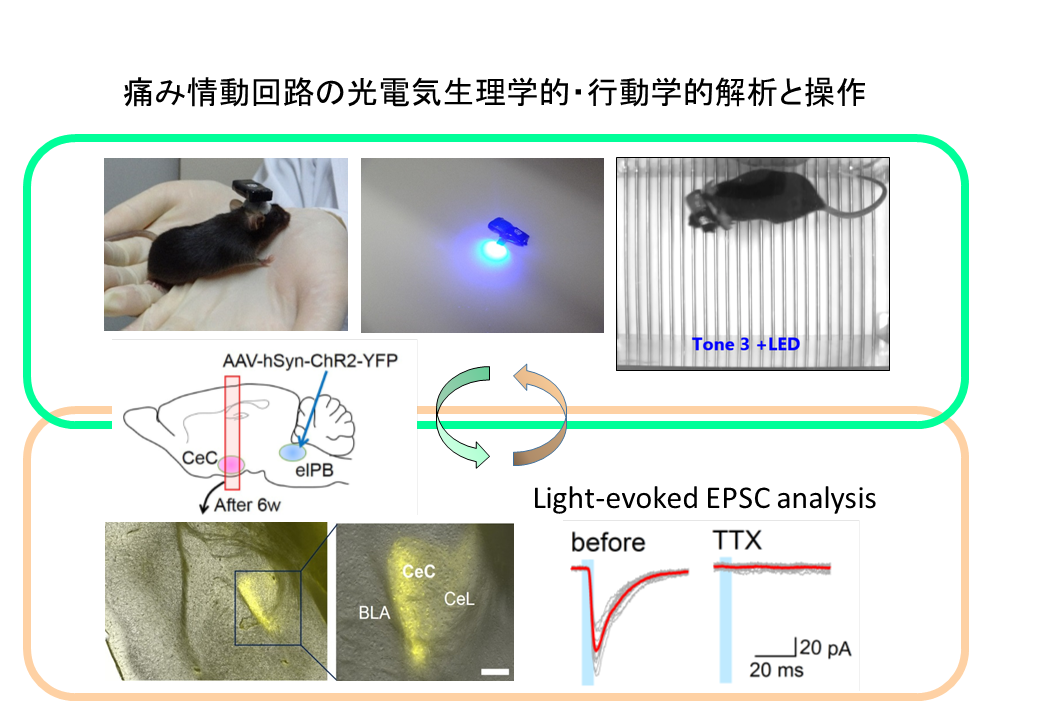
ストレス性精神疾患モデル動物における痛み情動回路の制御機構とその応用
 渡部 文子(東京慈恵会医科大学・総合医科学研究センター・神経科学研究部・准教授 )
渡部 文子(東京慈恵会医科大学・総合医科学研究センター・神経科学研究部・准教授 )
「痛み」など負の情動による恐怖記憶形成は、個体の生存維持に必須である一方、過度な恐怖記憶は心的外傷後ストレス障害(PTSD)やパニック障害など不安障害にもつながり、生活の質を大きく損なう。このような精神疾患の発症機構への手がかりとして、我々は橋の腕傍核から扁桃体に痛み信号を直接入力する「痛み情動回路」に着目した。この経路は慢性疼痛や恐怖記憶形成後にシナプス増強を示すことから、情動経路のシナプス増強による痛み負情動の破綻が情動障害に関与し、痛み神経回路可塑性破綻がマイクロ病態シナプスの本態であることを示唆する。そこで本領域では、情動障害を示すストレス性精神疾患モデル動物を用い、痛み情動回路の可塑性を光遺伝学的に操作することで破綻した恐怖記憶を再制御することを狙う。さらに光誘発性電気生理学的解析により、病態シナプスの分子機構を解明し、得られた手がかりを行動レベルで検討することで、新たな治療法開発に繋がる基礎的知見を得ることを目指す。
Identifying a microendophenotype of post-traumatic stress disorder
 Joshua Johansen(理化学研究所・脳科学総合研究センター・チームリーダー)
Joshua Johansen(理化学研究所・脳科学総合研究センター・チームリーダー)
Memories make us who we are. Our experiences in the world produce memories by physically changing the brain. Many experiences, like walking down the street to the store on a normal day, we do not remember. However, some memories, such as being attacked by a dog while walking down the street, are burned into our brains and stay with us for our entire lives. What tells the brain to store some experiences as memories while others are forgotten? How does this learning result in adaptive changes in behavior? Answering these questions is a central goal of our laboratory.
Aversive experiences, such as being attacked by a dog, are powerful triggers for memory storage. To accomplish this task, aversive encounters activate neural ‘teaching signal’ circuits which can trigger brain alterations resulting in memory formation.
In the lab we study how teaching signals regulate memory formation and guide adaptive behavior. To study this question we use a variety of aversively motivated behavioral assays including fear conditioning, a powerful model for studying emotional memories. Relative to our knowledge of sensory and motor circuits, we understand very little about the brain mechanisms which translate aversive experiences into neural teaching signals. As a result, there is important work to be done in this research area. Furthermore, the study of aversive teaching signal systems represents an important bridge between multiple areas of neuroscience research. By studying these circuits our ultimate goal is to discover general principles of neural circuit function, neural coding and plasticity as they relate to adaptive behavior. These insights may ultimately guide us toward a better mechanistic understanding of learning and memory, decision making, pain, emotion and many other aspects of human experience.
Dysfunction in aversive teaching signal circuits may underlie some of the clinical pathology associated with chronic pain and anxiety disorders. Understanding the mechanisms of aversive teaching signal circuits could also facilitate the development of novel treatments for these debilitating conditions.

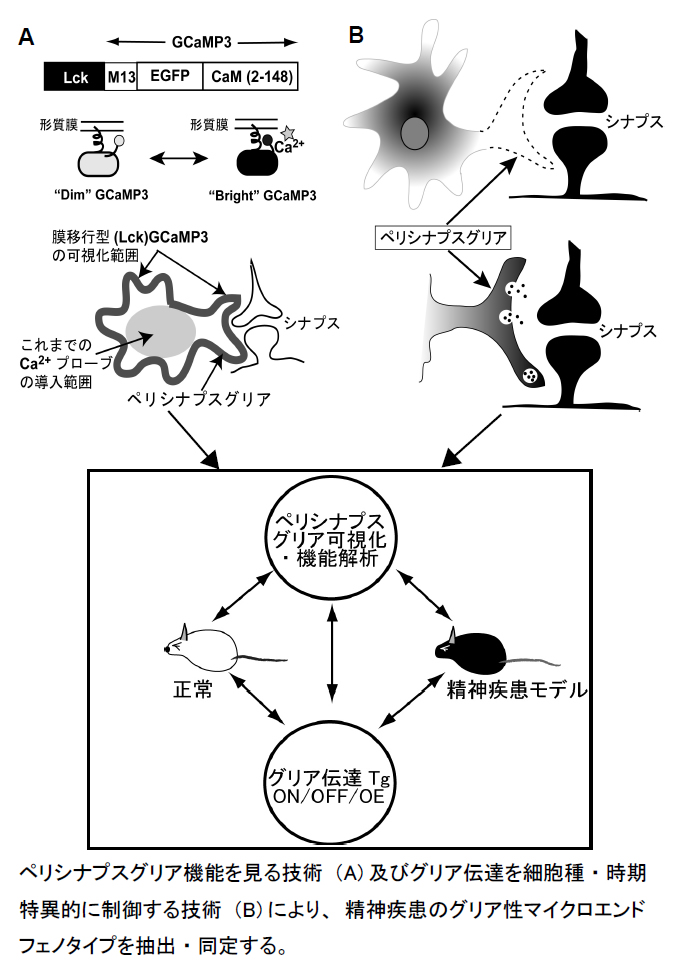
精神疾患のグリア性マイクロエンドフェノタイプ
 小泉 修一(山梨大学・医学部・薬理学講座・教授)
小泉 修一(山梨大学・医学部・薬理学講座・教授)
 連携研究者:繁冨 英治(山梨大学・医学部・薬理学講座・助教)
連携研究者:繁冨 英治(山梨大学・医学部・薬理学講座・助教)
グリア細胞が脳の情報処理・発信を制御していることが明らかとなり、脳機能は「神経-グリアネットワーク」コミュニケーションとして捉えられるようになった。従って、本ネットワークの変調は、脳の機能変調、特にシナプス伝達の変調や神経細胞の基礎活動性に影響すると考えられ、これは顕著な神経変性や神経細胞死を伴わない精神疾患の分子病態との関連性を強く示唆する。実際、うつ病や統合失調症患者の死後脳のトランスクリプトーム解析、プロテオーム解析では、グリア関連分子の変動が上位に並ぶ。さらに動物実験ではグリア細胞を阻害すると、抗うつ薬が奏功しないことも示された。神経−グリアネットワークのコミュニケーション変調と、精神疾患等各種脳疾患の分子病態は密接に関連すると考えられるが、両者の関連性の多くは不明のままである。その大きな理由は、神経とグリア細胞(アストロサイト及びミクログリア)がコミュニケーションを行うインターフェース「ペリシナプスグリア」の (1) 可視化・機能解析技術、(2) グリア伝達(グリア細胞による化学情報伝達)を精密に制御する技術、が欠如していたからである。本研究は、それぞれ(1)「膜移行型Ca2+プローブGCaMP3」によるペリシナプス機能解析、(2) FASTシステムによる細胞種・時期特異的「グリア伝達制御」、の2つの新技術により、この問題に応える。環境要因を再現した精神疾患モデル動物のペリシナプス機能を可視化し、またグリア伝達を精密に制御することにより、精神疾患における「グリア性マイクロエンドフェノタイプ」を抽出・同定する。また、本領域内で開発されたゲノム要因モデルを含む各種精神疾患モデルを用いた解析を行い、各精神疾患特異的なグリア性マイクロエンドフェノタイプの同定を目指すものである。
![]()
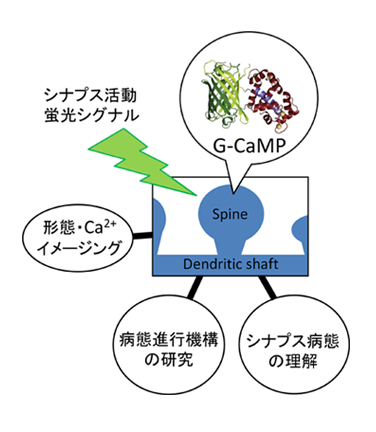
高感度シナプスカルシウムプローブを用いたスパイン病態進行機構の研究
 大倉 正道 (埼玉大学・脳科学融合研究センター・准教授)
大倉 正道 (埼玉大学・脳科学融合研究センター・准教授)
私たちは、脳の情報処理を担う神経回路における個々のシナプスの活動を細胞内カルシウムイオンの濃度変化を指標として目で見えるようにしながら、精神疾患の発現・進行に伴うシナプスの機能変化を明らかにしたいと考えています。単一シナプス活動の検出には高い性能(高感度、高シグナル、高輝度、高速応答性、タンパク質安定性、低副作用)を備えたプローブが必要となります。私たちの強みはイメージングにあります。私たちは蛍光カルシウムプローブタンパク質G-CaMPを開発し、またその後の改良を通じて、生体内の細胞活動の検出を可能にしてきました。私たちが開発したG-CaMPは線虫、ハエ、ゼブラフィッシュ、マウス、ラット、サル等多くのモデル生物で応用されています。最新のG-CaMPでは、マウスやラットの脳スライスにおいてシナプス前細胞の単一発火に応答したシナプス後細胞の個々の樹状突起スパインのカルシウム活動を感度良く検出できることを確認しています。私たちは最新の高性能なプローブを使用できる環境にあります。
本研究では海馬シナプスの形態と機能の変化に注目します。海馬は記憶の形成や想起に関わる脳部位であり、海馬錐体細胞においてグルタミン酸作動性の興奮性シナプスの入力部位である個々の樹状突起スパインが記憶に重要であると考えられています。統合失調症等の一部の精神疾患では進行性の記憶障害が生じますが、そのマイクロ病態として海馬でのスパインの萎縮やスパイン数の減少等が明らかにされてきました。しかしこれらのマイクロ病態がどのように進行しているのかは未だに解明されていません。そこで本研究では、海馬スライスの錐体細胞を標本として用い、進行性の記憶障害を誘発させる薬物の投与や遺伝子の操作によって個々のスパインの形態・機能やシナプス近傍の神経内外環境がどのように変化するのかを明らかにし、記憶障害の発現・進行に関わるマイクロ病態を解明することを目指します。
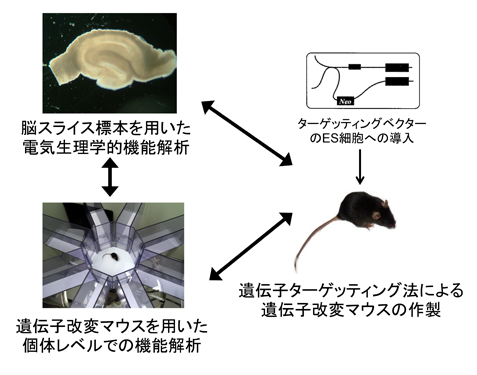
精神神経疾患の発症基盤としてのNMDA受容体の制御機構の解明
 真鍋 俊也 (東京大学医科学研究所・教授)
真鍋 俊也 (東京大学医科学研究所・教授)
哺乳類の中枢神経系の興奮性シナプス伝達では、ほとんどの場合、グルタミン酸が神経伝達物質として作用する。グルタミン酸がシナプス前終末から放出されると、シナプス後細胞のスパイン上に存在するグルタミン酸受容体に結合して、シナプス後細胞の興奮性を調節する。グルタミン酸受容体には、受容体チャネルを開口しイオンを透過させるAMPA受容体、NMDA受容体、および、カイニン酸受容体の3種類のイオン透過型受容体とシナプス後細胞内のシグナル伝達系を調節する8種類の代謝型受容体が存在し、そのいずれもが神経系の機能発現に重要な役割を担っている。当研究室では、これまでに、いずれのタイプの受容体についても、その機能解析を進めてきたが、その中でも、NMDA受容体については、正常マウスあるいは遺伝子改変マウスの海馬および扁桃体のスライス標本を用いた電気生理学的解析や個体を用いた行動学的解析を積極的に進めてきた。
NMDA受容体は、同じイオン透過型であるAMPA受容体とは異なり、1価の陽イオンだけでなく、2価のカルシウムイオンも透過するという特性を有している。シナプスが高頻度で活性化すると、細胞内のカルシウムイオン濃度が大きく上昇し、種々のカルシウム依存性の生化学過程を調節する。その代表的な例として、シナプス伝達の長期増強が挙げられる。また、個体レベルでは、記憶・学習のような高次機能だけでなく、種々の精神神経疾患にNMDA受容体が関与していることも明らかになりつつある。その中でも、グルタミン酸と同時にNMDA受容体に対してコアゴニストとして作用するD-セリンが、統合失調症や不安障害に関与する可能性が示唆されている。本研究計画では、正常マウスやD-セリンの制御に関与する分子の遺伝子改変マウスを用いて、分子レベル、細胞・ネットワークレベル、さらには、個体レベルでD-セリンの生理機能を明らかにすることを目指す。
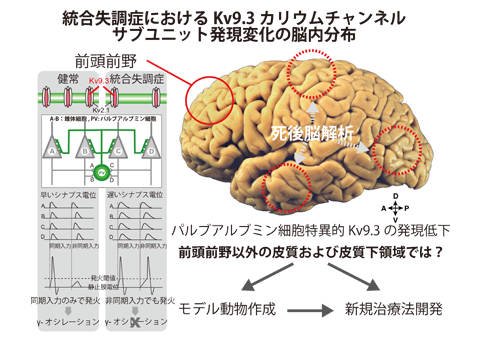
統合失調症におけるKv9.3カリウムチャンネルサブユニット発現変化の脳内分布
 橋本 隆紀 (金沢大学・医学系・脳情報病態学 (神経精神医学)・准教授)
橋本 隆紀 (金沢大学・医学系・脳情報病態学 (神経精神医学)・准教授)
統合失調症の大脳皮質では、GABA作動性介在ニューロンの中でもパルブアルブミン(PV)を発現するサブタイプ(PVニューロン)の機能低下を示す死後脳所見が集積している。PVニューロンは周期性皮質活動γオシレーションの形成を介して認知機能に重要な役割を果たすので、統合失調症ではPVニューロンの機能低下がγオシレーションの異常を引き起こし認知機能障害に結びついていると考えられる。Kv9.3カリウムチャンネルサブユニットは、皮質PVニューロンに特異的に発現し、Kv2.1サブユニットと複合体チャンネルを形成する。Kv2.1/Kv9.3複合体チャンネルは、発火閾値以下の膜電位によっても活性化される。PVニューロンにおいて、発火閾値以下K+の透過性は、周囲の錐体ニューロンによって形成される興奮性シナプスにおけるシナプス電位の時間経過を早める効果があることが報告されていた。早い興奮性シナプス電位は短い時間においてのみ積算されるので、PVニューロンは周囲の錐体ニューロンの同期性の高い活動によってのみ発火する特性を有し、これがγオシレーションの形成に役立っていると考えられる。最近我々は、統合失調症の前頭前野においてKv9.3 mRNAの発現低下を見出した。すなわち、Kv9.3の低下がγオシレーション異常及び認知機能障害の分子メカニズムの一つである可能性がある。本研究では、大脳皮質や皮質下の様々な領域においてKv9.3 mRNAの発現様式や統合失調症での変化を解明することで、病態のモデル動物の作成に加え、Kv9.3サブユニットを標的とした治療法の開発に役立てる。本研究は、ピッツバーグ大学精神医学部門の死後脳バンクより脳組織の提供を受けて行う。
免疫電子顕微鏡(凍結割断および3次元)を用いたシナプスとグリアの微細形態異常解析
 研究代表者:木下 専(名古屋大学・理学研究科・教授)
研究代表者:木下 専(名古屋大学・理学研究科・教授)
 連携研究者:深澤有吾(名古屋大学・医学系研究科・准教授)
連携研究者:深澤有吾(名古屋大学・医学系研究科・准教授)
発達障害や統合失調症の患者死後脳や精神疾患モデル動物において、興奮性シナプスにおける樹状突起棘(スパイン)の形態や容積の異常が多数報告されている。加えて、シナプス近傍の微細構造や、精神疾患との関連が深いシナプス分子(グルタミン酸やドーパミンの受容体・輸送体、足場蛋白質など)の数や分布も精神症状ないし行動異常と相関するマイクロエンドフェノタイプとしての有用性が期待される。これらの情報を必要十分な空間分解能で取得できるイメージング手法は免疫電子顕微鏡法に限られる。申請者らは、統合失調症や双極性障害患者脳で蓄積する複数のセプチン(シナプス膜およびグリア膜直下の足場蛋白質)のうちSEPT4の欠損がマウスの線条体/側坐核シナプスの微細形態と分子動態に及ぼす影響を探索し、軸索終末のドーパミン輸送体DATの減少が行動(薬理)学的異常をもたらすことを示した(Neuron 2007)。本研究では行動学的異常(常同行動、固執傾向、迷路学習における拙速性など)を呈する別のセプチン欠損マウスの海馬や線条体の微細形態と分子局在に関する定量的指標を3次元免疫電顕(連続切片immuno-TEM)再構築法で抽出するとともに、シナプス間隙~シナプス膜近傍の重要分子の定量評価には連携研究者の専門とする凍結割断レプリカ標識(SDS-FRL)免疫電顕法を適用する。対照群との差異をマイクロエンドフェノタイプとみなし、このうち行動(薬理)学的解析で得られた定量的フェノタイプに対する寄与度が高い指標を同定し、病態における意義を検証する。上記の微細形態計測手法を領域内で共有し、共同研究によって他グループが研究対象とする分子、実験系、精神疾患モデル動物にも解析対象を拡張することで領域の推進に貢献する。
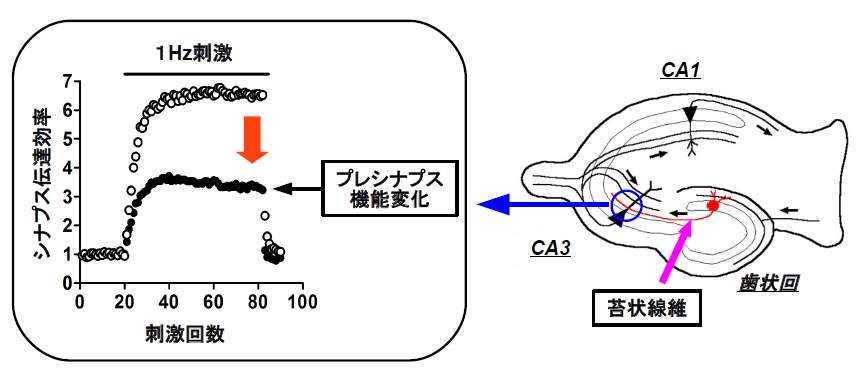
精神疾患のプレシナプスエンドフェノタイプとその発現機構の解析
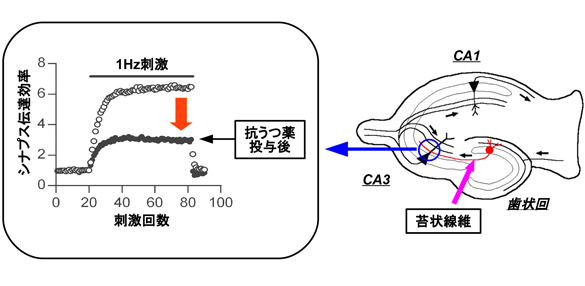
 小林克典(日本医科大学・薬理学・講師)
小林克典(日本医科大学・薬理学・講師)
精神疾患において中枢シナプス伝達の異常が示唆されているが、シナプスのどのような異常が特定の疾患もしくは症状に寄与するのかは不明である。我々は顕著な精神疾患様の行動異常を示すα-CaMKIIヘテロ欠損マウス(CaMKII+/-)の表現型解析結果に基づき、海馬歯状回の成熟異常が精神疾患のエンドフェノタイプとなる可能性を提唱した。このマウスの最も顕著な機能異常はシナプス伝達のプレシナプス側の変化として観察される。歯状回から海馬CA3に投射する苔状線維が形成する興奮性シナプスでは、頻回刺激によって巨大なシナプス促通(プレシナプス性の短期的増強)が見られるが、CaMKII+/-ではこの促通が非常に強く抑制されていた。同様の促通の低下がSchnurri-2欠損マウス(Shn2-/-)、変異型SNAP-25ノックインマウス、高用量の抗うつ薬フルオキセチンを慢性投与したマウスなどにおいても見られ(図参照)、いずれも顕著な行動異常と歯状回の成熟異常を伴う。また、統合失調症脆弱性遺伝子Dysbindin-1、Disc1の変異マウスでも苔状線維シナプス促通の軽度の異常が報告されている。Shn2-/-の行動異常は多くの点で統合失調症の症状に類似しているが、CaMKII+/-の異常は統合失調症と双極性障害の中間的である。抗うつ薬は躁転、気分不安定化を起こすことが知られている。以上を考慮すると、苔状線維のシナプス促通の低下は、特定の疾患ではなく、統合失調症や双極性障害(のサブグループ)、薬物誘発性の行動異常に共通した神経病態に寄与する可能性が考えられる。本研究では、マウスの海馬苔状線維シナプスをモデル系として、精神疾患病態に関与すると考えられるプレシナプスエンドフェノタイプの発現機構を解析し、プレシナプス機能の正常化による行動異常の改善を試みる。さらにこのエンドフェノタイプの一般性を検討するとともに、機能変化と直結したバイオマーカーを探索する。
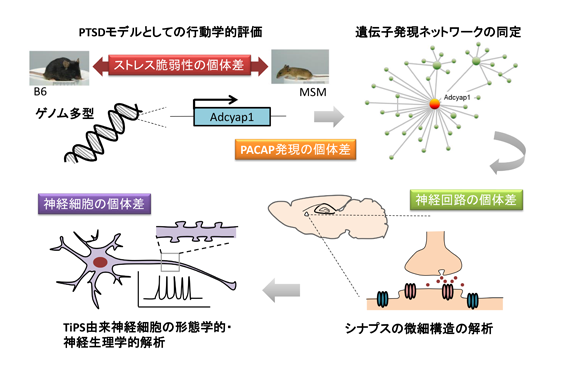
PACAP高発現マウスを用いたPTSD発症リスク個人差の神経基盤解析
 小出 剛(国立遺伝学研究所・マウス開発研究室・准教授)
小出 剛(国立遺伝学研究所・マウス開発研究室・准教授)
心的外傷後ストレス障害(PTSD)は、事故、災害、犯罪被害などの極度のストレス経験によって引き起こされる疾患で、生涯診断有病率が1%と推定されている。しかし、全ての人が極度のストレス経験の後にPTSDに罹るわけではなく、その発症リスクの個人差には遺伝的要因が関与していることが示されてきている。本研究では、このようなストレス脆弱性の個体差について、遺伝的基盤と、そのマイクロエンドフェノタイプを明らかにすることを目的とする。野生由来マウス系統であるMSMは、他の実験用マウス系統とくらべて極度に高い情動反応性を示す。我々は、コンソミック系統を用いた解析により、原因遺伝子としてPACAP遺伝子を同定した。この遺伝子がMSM型となっているマウス(PACAP高発現系統)は、ストレス応答が増強しており、また遺伝子産物であるPACAPペプチド量が増加していることが明らかとなった。神経ペプチドであるPACAPは、自律神経系の興奮制御に強く関わっており、PTSDの症状と関連することが患者の研究により報告されている。このことから本マウスは、ストレス脆弱性やPTSD罹患リスクの個人差メカニズムの探索において、有用なモデル動物になると期待される。
本研究では、領域支援班と協力して以下のような研究を行ない、PTSD発症リスクの個人差に関する研究に貢献することを目指す。
① PACAP高発現マウスの行動解析により、PTSDモデルとしての妥当性を検討
② ストレス応答の個体差に関わる遺伝子発現ネットワークの解析
③ PACAP発現量の違いによる神経回路微細構造の個体差解析
④ PACAP高発現マウス由来細胞の形態学的・神経生理学的特徴の解析
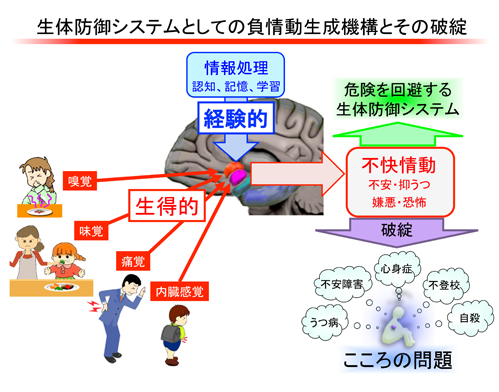
うつ病・不安障害モデル動物における分界条床核神経回路の機能的変化
 南 雅文 (北海道大学・薬学研究院・薬理学研究室・教授)
南 雅文 (北海道大学・薬学研究院・薬理学研究室・教授)
うつ病や不安障害を患うために、抑うつ・不安情動を生成する神経機構を有しているとは考え難い。ヒトを含む哺乳類は、危険な時間帯や場所において、また、疾患や傷害を患った際に、自らの行動を抑制し周囲に対する警戒をより高めることで身を守る生体防御システムとして、このような負情動生成機構を獲得・進化させてきたと考えられる。したがって、うつ病や不安障害のメカニズムを理解するためには、生体防御システムとしての抑うつ・不安の神経機構あるいはそれを構成する神経回路を明らかにした上で、患者あるいは病態モデル動物においてその神経機構・神経回路がどのように変化しているかを解析することが必要である(図:生体防御システムとしての負情動生成機構とその破綻)。我々は、これまで、痛みの情動的側面について、扁桃体や分界条床核に着目した研究を行ってきた(Eur J Neurosci, 18, 2343-2350 (2003); Behav Brain Res, 176, 367-371 (2007); J Neurosci, 28, 7728-7736 (2008); Neuropharmacology, 61, 156-160 (2011); J Neurosci, 33, 5881-5894 (2013))。最近では、分界条床核2型神経細胞の活動亢進が負情動生成に重要であることを明らかにした。本研究では、嫌悪・不安情動生成における分界条床核の役割に関する申請者らのこれまでの研究成果を基盤として、うつ病・不安障害モデル動物における、分界条床核神経細胞のシナプス伝達と神経細胞興奮性、およびそれらに対する各種神経情報伝達物質・神経ペプチドの効果を解析することにより、疾患マイクロエンドフェノタイプとなる神経機構・神経回路の機能的変化を見出すとともに、うつ病・不安障害の神経機構を明らかにすることを目的とする。
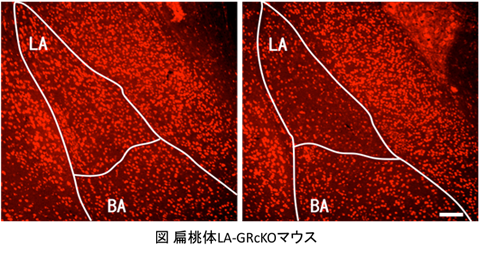
ストレス性精神疾患における扁桃体外側核の役割の解明
 森 寿(富山大学・大学院医学薬学研究部(医学)・分子神経科学講座・教授)
森 寿(富山大学・大学院医学薬学研究部(医学)・分子神経科学講座・教授)
 連携研究者:井上 蘭(富山大学・大学院医学薬学研究部(医学)・分子神経科学講座・助教)
連携研究者:井上 蘭(富山大学・大学院医学薬学研究部(医学)・分子神経科学講座・助教)
気分障害や不安障害等のストレスが関わる精神疾患の生涯有病率は、我が国では20%近くに達しており、国民の健康福祉や経済的観点から克服すべき課題のひとつである。ストレス性精神疾患の原因のひとつとして、扁桃体が担う情動制御の異常が示唆されている。
我々は、ストレスホルモンのひとつであるグルココルチコイド受容体(GR)遺伝子を扁桃体外側核(LA)選択的に欠損させた (LA-GRcKO) マウス系統を作製した(図)。LA-GRcKO マウスでは、恐怖条件付けを用いた情動学習課題で、記憶の獲得異常が観察され、恐怖記憶形成にLAのGRが関わる事を初めて明らかにした。本研究では、このマウスを用いて情動が関わる行動の評価を進め、異常の原因となっている分子動態変化や細胞構造の変化等を明らかにし、心的外傷後ストレス障害(PTSD)をはじめとするストレス性の精神疾患や感情障害で見られる情動認知機能障害の分子機構ならびに責任神経回路を明らかにする。
まず、LA-GRcKOと野生型 (WT) コントロールマウスを用いて、情動記憶学習試験、恐怖反応試験、うつ症状試験等の一連の行動学的解析を行い、ストレス性精神疾患におけるLAでのGRの機能を明らかにする。このマウスの行動変化とGR遺伝子欠損の因果関係を明確にするために、GR発現ウィルスベクターのLA注入による機能回復を行動学的試験で評価する。さらに、マウスの扁桃体スライスを作製しマイクロダイセクション法によりLAならびに海馬を切り出し、トランスクリプトーム解析を実施し、GRの標的遺伝子群を明らかにする。見出した遺伝子産物の発現は、ウェスタンブロット法と免疫組織化学法により検証し、ストレス性精神疾患のあらたなバイオマーカーや薬物標的となりうるか評価を行う。領域内では積極的に共同研究を実施し、得られた研究成果を、学会発表や論文発表、HP情報として広く社会に発信する。
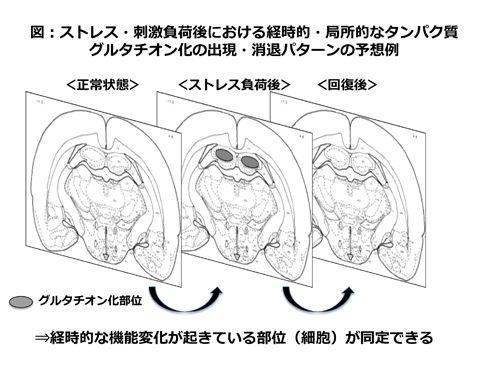
病態マーカーとしてのin situグルタチオン化タンパク質検出法の確立と応用
 戸田 重誠(金沢大学・附属病院・神経科精神科・講師)
戸田 重誠(金沢大学・附属病院・神経科精神科・講師)
酸化ストレスと言えば、一般に神経変性疾患で見られる細胞死のような非可逆的な強い反応が想像され、細胞死を伴わない精神疾患とは縁遠い印象がある。しかし実際には、細胞死に至らない一過性でマイルドな酸化ストレス(mild oxidative stress: MOS)が存在し、様々な細胞活動に影響するシグナルとして機能していると考えられている。例えば、うつ病を引き起こすような社会的ストレスや、過剰な運動、精神刺激薬の投与など、精神疾患発症の引き金となる要因の多くがMOSを誘導する。我々はこれまでに、薬理学的に連日MOSを誘導すると、動物の意思決定を慢性ストレス負荷後に見られるモードに誘導できることを確認した。しかもこの変化はストレス負荷終了後しばらく経って発現したことから、一過性の反応ではなく、より長期に持続する適応性の変化と推察された。では様々なMOSは各精神疾患において、脳のどの部位で、どのような分子レベルの変化を経て、高次行動の変化をもたらすのか?この問いに答えるには、まず脳内のどこでMOSが影響しているのか網羅的に知る必要がある。
そこで我々は酸化ストレスに拮抗する機序の一つ、タンパク質のグルタチオン化という現象に着目した。これはタンパク質が酸化され非可逆的に構造変化するのを防ぐ反応で通常可逆的だが、多くの場合タンパク質の機能変化を伴う。タンパク質のグルタチオン化を脳内でin situで検出できれば、MOSが脳内のどのような回路・細胞に影響を与え、そこでどのようなタンパク質が機能変化しているのかを知る上で重要な手がかりとなる。本研究グループは、in situグルタチオン化タンパク質検出法を動物脳で初めて確立し、うつ病や薬物依存などMOSの関与が予想される精神疾患の動物モデルを用いてMOSの標的部位を同定することで、MOSが関与する精神疾患発症の病態解明と治療法の開発を目指す。
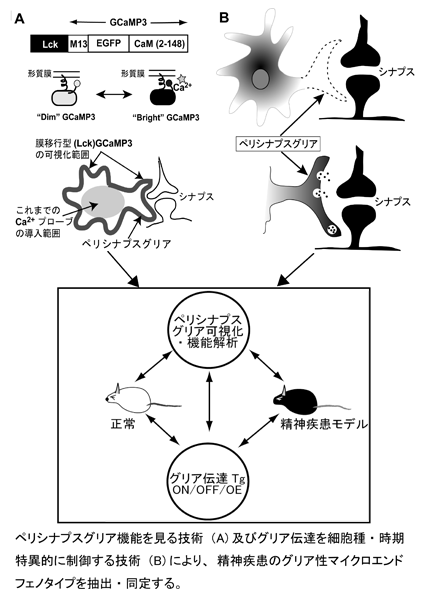
精神疾患のグリア性マイクロエンドフェノタイプ
 小泉 修一(山梨大学・医学部・薬理学講座・教授)
小泉 修一(山梨大学・医学部・薬理学講座・教授)
 連携研究者:繁冨 英治(山梨大学・医学部・薬理学講座・助教)
連携研究者:繁冨 英治(山梨大学・医学部・薬理学講座・助教)
グリア細胞が脳の情報処理・発信を制御していることが明らかとなり、脳機能は「神経-グリアネットワーク」コミュニケーションとして捉えられるようになった。従って、本ネットワークの変調は、脳の機能変調、特にシナプス伝達の変調や神経細胞の基礎活動性に影響すると考えられ、これは顕著な神経変性や神経細胞死を伴わない精神疾患の分子病態との関連性を強く示唆する。実際、うつ病や統合失調症患者の死後脳のトランスクリプトーム解析、プロテオーム解析では、グリア関連分子の変動が上位に並ぶ。さらに動物実験ではグリア細胞を阻害すると、抗うつ薬が奏功しないことも示された。神経-グリアネットワークのコミュニケーション変調と、精神疾患等各種脳疾患の分子病態は密接に関連すると考えられるが、両者の関連性の多くは不明のままである。その大きな理由は、神経とグリア細胞(アストロサイト及びミクログリア)がコミュニケーションを行うインターフェース「ペリシナプスグリア」の(1)可視化・機能解析技術、(2)グリア伝達(グリア細胞による化学情報伝達)を精密に制御する技術、が欠如していたからである。本研究は、それぞれ(1)「膜移行型Ca2+プローブGCaMP3」によるペリシナプス機能解析、(2) FASTシステムによる細胞種・時期特異的「グリア伝達制御」、の2つの新技術により、この問題に応える。環境要因を再現した精神疾患モデル動物のペリシナプス機能を可視化し、またグリア伝達を精密に制御することにより、精神疾患における「グリア性マイクロエンドフェノタイプ」を抽出・同定する。また、本領域内で開発されたゲノム要因モデルを含む各種精神疾患モデルを用いた解析を行い、各精神疾患特異的なグリア性マイクロエンドフェノタイプの同定を目指すものである。
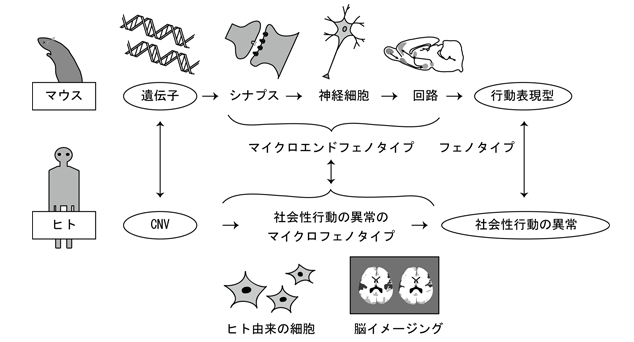
社会性行動の異常に関わる回路のマイクロエンドフェノタイプの解明
 櫻井 武(京都大学大学院・医学研究科・メディカルイノベーションセンター・准教授)
櫻井 武(京都大学大学院・医学研究科・メディカルイノベーションセンター・准教授)
社会性行動の異常は自閉症のみならず、様々な精神疾患に見られる行動表現型である。社会性行動は社会性刺激への単純な反応から始まり、個体の成長に伴って刺激に対してより複雑な対応をする様になっていくが、おそらくこれは発達の段階において社会性行動に関与する様々な神経回路が形成され、成熟することにより社会性行動を支えるのに必要な様々な能力が獲得されることによると考えられる。自閉症や統合失調症といった発達精神障害ではこういった神経回路の形成、成熟過程に異常が生じ、結果として社会性行動の異常という表現型が生じると考えられる。
ヒトの精神疾患に染色体の微小欠損、重複によるコピー数変異が関与していることがゲノム解析から明らかになってきているが、その中で、染色体の7q11.23領域は、その欠損が過剰な社会性行動をその特徴的な行動表現型として示すWilliams-Beuren症候群(WBS)を、またその重複が自閉症を示すことから、コピー数依存性に社会性行動を支える神経回路の形成に関わる遺伝子を含むことが示唆されている。我々は、WBSの非典型欠損例の遺伝子型-表現型相関の解析から、その領域の遺伝子の一つである転写調節因子であるGtf2iがその有力な候補ではないかとの仮説を立て、これを1コピー欠損したマウスを作製し、それがWBS様の過剰な社会性行動を示すことを明らかにした。また、1コピー過剰に持つマウスは自閉症様の症状を示すことが予測され、現在そのマウスを作製しその行動表現型を解析している。
ヒトゲノム解析の知見に裏付けられたこれらのマウスモデルは社会性行動の異常の根本にある神経細胞及び回路レベルでの発達段階での変化(マイクロエンドフェノタイプ)を解析するのに有用であると考えられる。当該領域で得られる新しい技術を利用して社会性行動の異常に関わるマイクロエンドフェノタイプを解明し、それらを当該領域で得られるヒトの知見と比較することにより、様々な精神疾患に付随する社会性行動の異常のメカニズムに迫る。
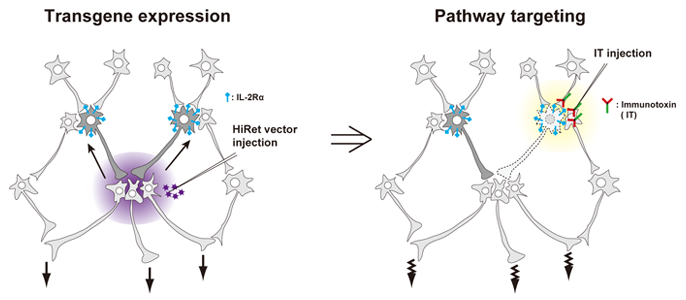
前頭前野皮質回路の遺伝子操作による病態モデル解析
 小林 和人(福島県立医科大学・医学部・生体機能研究部門・教授)
小林 和人(福島県立医科大学・医学部・生体機能研究部門・教授)
私たちの研究室では、遺伝子改変技術を利用して、大脳皮質―基底核-視床ネットワークを介する学習や行動制御のメカニズムの解明に取り組んでいます。マウスやラットというげっ歯類を動物モデルとし、特定の神経細胞に目的の遺伝子を発現する動物を作製します。また、最近では、高頻度逆行性遺伝子導入ベクターという新しい技術を用いて、特定の神経路に遺伝子導入を行うことも可能になっています。このような技術を応用して、特定の神経路の機能を改変・操作し、回路の動態や行動への影響を解析することが可能になります。
統合失調症などの精神疾患の発病は、前頭前野皮質を中心とする脳領域の機能異常に起因し、それらをめぐる脳領域での物質代謝や神経伝達の変化が病態に深く関係することが知られていますが、精神疾患の病態の基盤となる脳内神経回路の障害のメカニズムについては十分に理解されていません。新学術領域研究では、内側前頭前野皮質 (medial prefrontal cortex/mPFC)を中心とする神経回路について、mPFC への入力経路およびmPFCに局在する GABA 作動性介在ニューロンの役割が、統合失調症様の行動障害にどのように関係するのかを解析したいと考えています。特に、mPFC 機能に依存する作業記憶および attentional shift 機能に着目して、これらの障害に結びつく神経回路機構の解明に取り組む計画です。
文献:(1) Kobayashi, K., Okada, K., and Kai, N. (2012) Functional circuitry analysis in rodents using neurotoxins/immunotoxins. In Neuromethods, Controlled Genetic Manipulations (ed. Alexei, M.), chapter 10, pp. 193-205. Humana Press Inc., New York. (2) Kato, S., Kobayashi, K., and Kobayashi, K. (2013) Dissecting circuit mechanisms by genetic manipulation of specific neural pathways. Rev. Neurosci. 24 (1) 1-8.
図の説明:選択的な神経路ターゲティング技術
組み換え体イムノトキシン(IT) に対する受容体遺伝子をコードする高頻度逆行性遺伝子導入(HiRet)ベクターを脳領域に注入し、複数の入力経路に遺伝子を導入する。その後、上流の特定領域にイムノトキシンを注入することにより、特定神経路の除去を誘導する。
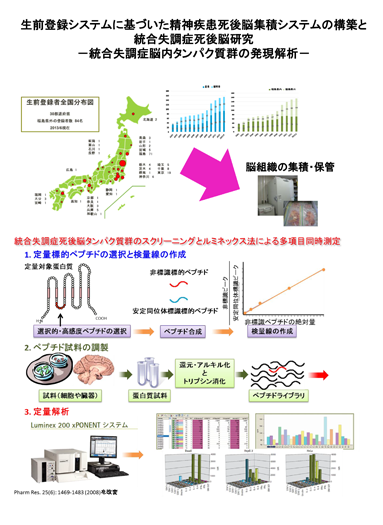
統合失調症脳内タンパク質群の発現解析-タンパク質多項目同時測定システムを用いて-
 國井 泰人(福島県立医科大学・神経精神医学講座・助教)
國井 泰人(福島県立医科大学・神経精神医学講座・助教)
私は、2003年4月より、福島精神疾患死後脳バンク(http://www.fmu-bb.jp/index.htm)の運営と拡充に従事して参りました。生前登録促進のための啓発活動や同意の取得、保管死後脳例の臨床情報の整理・データベース化、ホルマリン固定脳のパラフィン切片化、ネットワーク病院運営委員との関係強化、登録者死亡時から遺体搬送・脳の切り出し・保存までの一連の業務、国内外の研究施設へのバンク保存脳サンプルの提供の実務を行っています。
同バンクのサンプルを用いた統合失調症発症のメカニズムに関する研究として、統合失調症死後脳におけるDARPP-32及びカルシニューリンの免疫組織化学的プロファイルをテーマとして行ってきました。2011年からは、米国国立衛生研究所に留学し、精神疾患死後脳におけるDARPP-32の発現異常とSNPs遺伝子型の関連解析を行いました。
本研究ではこれまでの研究を踏まえ、統合失調症死後脳に発現しているタンパク質の多項目同時測定を進める予定です。ドパミン関連分子、グルタミン酸関連分子、GABA関連分子を標的タンパク質として、統合失調症群と健常対照群の死後脳凍結組織における発現量の差異を、熊本大学薬学部大槻純男教授らの開発した質量分析法による網羅的なタンパク質絶対定量解析法を用いてスクリーニングしたタンパク質について、脳内の複数の部位でルミネックス法によるタンパク定量を行います。さらに免疫組織化学的手法を用いて、より詳細な標的タンパク質の組織内分布を観察し発現している細胞を同定し、統合失調症群に関しては、当バンク特有の詳細な臨床情報を駆使して関連を検討します。解析した分子の中で異常が捉えられたものについては、レーザーマイクロダイセクションにより、免疫組織化学解析と同じ解析部位の組織を抽出し、局所的遺伝子発現やエピジェネティクス解析も実施したいと考えています。
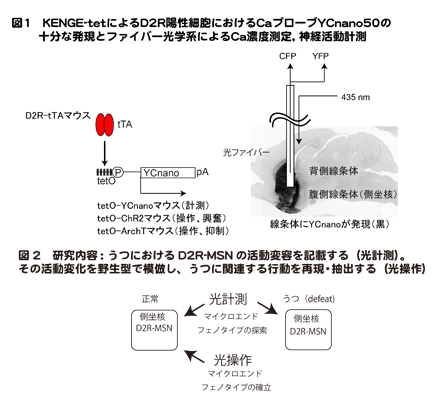
うつ病における神経回路変容の抽出と解析
 田中 謙二(慶應義塾大学・医学部・精神神経科学教室・情動の制御と治療学研究寄附講座・特任准教授)
田中 謙二(慶應義塾大学・医学部・精神神経科学教室・情動の制御と治療学研究寄附講座・特任准教授)
うつ病における側坐核の活動変容は、ヒト脳機能イメージングの結果・深部脳刺激のターゲットと、妥当性の高いうつ病モデルを用いた神経活動マーカーの発現様式から支持される。しかし、側坐核には全く機能の異なる2 種類の神経細胞(直接路と間接路)がランダムに配置しているために、これらの異なる細胞集団の活動を切り分けて記載してはじめて活動変容をマイクロエンドフェノタイプとして確立できるようになる。
申請者が独自に開発した改良型テトラサイクリン遺伝子発現誘導システムをもちいて、側坐核間接路神経細胞特異的にカルシウムセンサー: yellow cameleon nano50(YCnano)、チャネルロドプシン、アーキロドプシンを発現する遺伝子改変マウスをそれぞれ用意する。覚醒下で脳深部に存在する側坐核神経活動変化をカルシウム濃度計測によってモニターするための光計測システムを構築する。このシステムで、側坐核間接路神経細胞の活動亢進、活動抑制が正しく計測できているかコントロール実験を行う。体の大きいマウスに5 日間連続で襲わせて実験マウスをうつ状態におちいらせるSocial defeat(社会挫折)うつ病モデルを作成する。うつ状態におちいる前後の側坐核間接路神経細胞の活動を上述の覚醒下深部脳カルシウムイメージング法で調べ、うつ状態に伴う活動変容を明らかにする(マイクロエンドフェノタイプの探索)。Defeat 後に観察される活動変容がどのような行動変化の原因になっているか明らかにするため、光感受性チャネル(チャネルロドプシン、アーキロドプシン)を用いて側坐核間接路神経細胞の活動性を光で操作し、活動変容を正常マウスで再現する。Defeat 後に観察される活動変容が不安、葛藤、意欲をどのように変化させるか明らかにし、うつ病の側坐核間接路神経細胞の活動変容をマイクロエンドフェノタイプとして確立する。
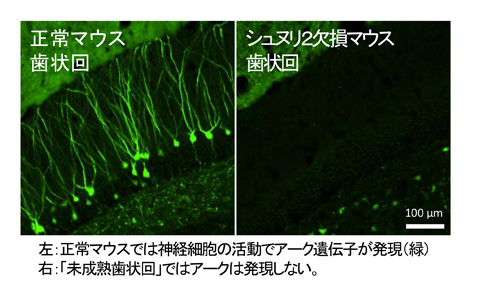
非定型炎症を伴う精神疾患モデル動物を活用したマイクロ精神病態の同定と分子機序解明
 宮川 剛(藤田保健衛生大学・総合医科学研究所システム・医科学研究部門・教授)
宮川 剛(藤田保健衛生大学・総合医科学研究所システム・医科学研究部門・教授)
私たちは、これまでに160系統以上の遺伝子改変マウスの行動を網羅的に解析し、多数の精神疾患モデルマウスを同定してきました。それらの一部のマウスに共通して、成体であるにもかかわらず海馬歯状回のほぼ全ての神経細胞が未成熟な状態にあるという現象 -非成熟歯状回- が生じていることを世界で初めて報告しました1。非成熟歯状回様の現象は統合失調症や双極性障害の患者の死後脳でも見られることもわかり2、私たちは非成熟歯状回を統合失調症や双極性障害などの精神疾患のエンドフェノタイプ候補の一つとして提唱しています。最近、ひときわ顕著な行動異常パターンと非成熟歯状回を示すマウスとしてSchnurri-2ノックアウト(Shn-2 KO)マウスを同定しました3。このShn-2 KOマウスは、脳の遺伝子発現パターンが統合失調症患者の死後脳のものと酷似していたほか、抑制性神経細胞マーカーのパルバルブミンや各種オリゴデンドロサイトマーカーの減少、シータ波・ガンマ波などの脳波異常など統合失調症患者の脳で報告されている多くの特徴を備えており、優れた統合失調症モデルマウスであることがわかりました。さらに、Shn-2 KOマウスを含めた非成熟歯状回を持つマウスや統合失調症患者の脳では、軽度で慢性的な炎症が生じていることが明らかとなり、これが統合失調症の各種のエンドフェノタイプの背景にある可能性があります。しかし、軽度の慢性炎症がなぜ生じ、それがどのような脳の異常を引き起こしているのかは未だ明らかではありません。本研究では、脳の軽度慢性炎症によって誘導される神経細胞やグリア細胞の各種の異常を精神疾患のマイクロエンドフェノタイプとして捉え、(1)遺伝的・環境的要因が軽度慢性炎症を引き起こすメカニズムを解明すること、 (2)軽度慢性炎症が原因となって生じるマイクロエンドフェノタイプを同定し制御すること、を目指します。
1. Yamasaki et al. Mol. Brain, 1, 6 (2008).
2. Walton et al. Transl. Psychiatry, 2, e135 (2012).
3. Takao et al. Neuropsychopharmacology, 38, 1409-1425 (2013).
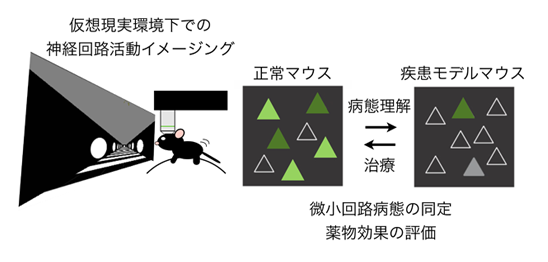
仮想現実環境下の機能イメージングによる精神・発達障害の微小回路病態の解明
 佐藤 正晃(理化学研究所・脳科学総合研究センター・研究員)
佐藤 正晃(理化学研究所・脳科学総合研究センター・研究員)
 連携研究者:水田恒太郎(理化学研究所・脳科学総合研究センター・研究員)
連携研究者:水田恒太郎(理化学研究所・脳科学総合研究センター・研究員)
種々の精神疾患で認められる行動異常の背後にある神経回路機能の異常を同定するには、行動中の動物の回路活動を大規模かつ高解像度に計測する技術の確立が不可欠である。本研究では、われわれがこれまでに確立したin vivo深部脳イメージング、蛍光カルシウムセンサータンパク質発現トランスジェニックマウス、およびマウス用仮想現実(バーチャルリアリティ、VR)提示システムなどの先端技術を精神疾患研究に応用し、顕微鏡周囲に作り出されたVR環境下で行動する疾患モデルマウスの海馬神経回路活動を、単一細胞解像度の二光子カルシウムイメージングで可視化することで、その微小な機能回路異常を同定する。
VRは被験者に提示する感覚刺激の量と質を柔軟に設定できるため、特に米国をはじめとする海外の精神科領域では、種々の不安障害のリハビリテーションなどに積極的に治療応用されている。基礎脳科学では以前からヒトやサルの脳研究における行動課題に利用されていたが、近年ラットがVR空間をナビゲーションできることが報告されて以降、げっ歯類の行動実験系として急速にその重要性を増している。特に、VRは二光子レーザー顕微鏡や多チャンネル細胞外記録などの先端的な回路機能計測法との親和性が高く、精神疾患の微小な機能回路病態の解明に大きな潜在的有用性をもっている。
本研究では、特に興奮性シナプスに存在するタンパク質の欠損によりヒトの精神疾患や発達障害に似た表現型を示す疾患モデルマウスに注目し、このようなモデルマウスのイメージングで同定された神経回路活動の異常が、薬物治療の候補となるような化合物の投与によって改善されるかどうかを検証する。
CA2 Disinhibition and Schizophrenic Phenotypes
 McHugh Thomas(理化学研究所・脳科学総合研究センター・チームリーダー)
McHugh Thomas(理化学研究所・脳科学総合研究センター・チームリーダー)
Our laboratory is interested in how circuits in the brain interact to store, organize, recall and use memories. We employ a highly multidisciplinary approach that extends from molecules to circuits and behavior, utilizing genetic approaches, in vivo electrophysiology and neurochemistry.
Several of the lab's projects address how the hippocampus assigns different aspects of mnemonic processing to the specialized, interconnected networks that correspond to the main hippocampal anatomical subfields; the dentate gyrus (DG), CA3, CA2 and CA1 areas, while others focus on factors, both intrinsic and extrinsic to the hippocampus, that modulate a memory's salience and persistence. Finally, the lab retains an interest in understanding the dysfunctional brain, with projects focused on the mechanisms and impacts of epilepsy, stress and schizophrenia on memory and cognition.
Two current projects include:
CA2 and Hippocampal Novelty Encoding
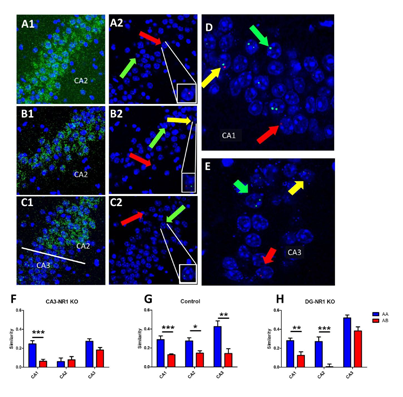
Contextual learning involves associating cues with an environment and relating them to past experience. Previous data indicate functional specialization within the hippocampal circuit: the dentate gyrus (DG) is crucial for discriminating similar contexts, while CA3 is required for associative encoding and recall. We have employed Arc/H1a catFISH imaging to address the contribution of the largely overlooked CA2 region to contextual learning by comparing ensemble codes across CA3, CA2, and CA1 in mice exposed to familiar and novel contexts. Further, to manipulate the quality of information arriving in CA2 we used two hippocampal mutant mouse lines as ‘circuit alleles’ that result in hippocampal activity that is uncoupled from the animal’s experience. The loss of NMDA receptors at the CA3 recurrent synapses (CA3-NR1 KO mice) leads to deficits in rapid encoding of information and associative memory storage(Nakazawa et al., 2002; McHugh and Tonegawa, 2009), essentially a CA3 representation that is more novel than it should be, while in contrast, the loss of NRs at the perforant path inputs from the entorhinal cortex to the DG (DG-NR1 KO mice) results in deficits in context discrimination (McHugh et al., 2007); i.e. in CA3 novel contexts appear more familiar than experience dictates. Our data reveal largely coherent responses across the CA axis in control mice; however the CA2 response became uncoupled from CA1 and CA3 in the mutant mice. Moreover, we show in normal mice that CA2 is more sensitive to subtle changes in context. Our data suggest that CA2 may be tuned to remap in response to any conflict between stored and current experience.
Habenula/Hippocampal Interactions
Damage to the habenular complex (HbCpl) results in a wide-range of behavioral changes, including specific deficits in spatial learning tasks and changes in emotional behavior. Lateral habenular recording in primates suggests these neurons may fire in response to negative motivational value and are suppressed by reward. The anatomy in both the rodent and primate support the ‘aversive signaling’ hypothesis, with excitatory projections from the habenula terminating on GABAergic neurons in the RMTg and VTA that, in turn, inhibit dopamine release (Jhou et al, 2009; Hong et al, 2011) Further, data from multiple species, including humans, suggests dysfunction in the lateral habenula may underlie serious disorders, such as severe depression and schizophrenia (Shumake et al, 2003; Sarotius and Henn, 2007; Savitz et al, 2011). Given the usefulness of the mouse as an experimental model and the powerful genetic approaches available, it is of great interest to assess if habenular neurons encoding aversive outcomes in a similar fashion in the mouse and to study the circuit that underlies their function in learning and behavior. To better understand how this region encodes aversive stimuli in the rodent, we are recording from the lateral habenula (LH) and hippocampus (HPC) of the freely behaving mouse. Mice are trained to run for a food reward (sucrose pellets) on a circular track with four possible reward locations (NE, SE, SW, NW). In each trial only 2 locations contain reward (NE/SW or SE/NW), while at the non-rewarded locations the mouse receives a small aversive air puff , with the location of the rewards and airpuffs pseudo-randomly alternated between trials. In this paradigm we have identified single units in the LH that show a robust increase in their firing rate at the locations the air puffs are delivered. These aversive stimuli responsive neurons come in at least two types; a regular spiking, non-bursting type that exhibits no theta-modulation and a relatively narrow waveform and a theta-modulated bursting type with a relatively wide waveform. These data are being employed to better characterize this circuit in the mouse and understand its interactions with the spatial representation present in the hippocampus.
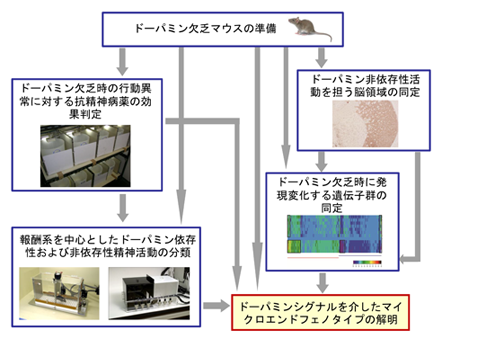
ドーパミンシグナルを介した精神疾患病態に関するマイクロエンドフェノタイプの解明
 池田 和隆(東京都医学総合研究所・依存性薬物プロジェクト・プロジェクトリーダー)
池田 和隆(東京都医学総合研究所・依存性薬物プロジェクト・プロジェクトリーダー)
ドーパミンは、快情動、人格、注意など主要な精神活動や運動を制御する極めて重要な脳内物質であり、実際、様々な抗精神病薬の全てが、ドーパミンシグナル伝達を修飾する作用を有することや、依存性薬物のほとんどが側坐核におけるドーパミンの放出を引き起こすことが知られている。従って、ドーパミンシグナルの変調は精神疾患病態におけるマイクロエンドフェノタイプであると考えられる。ドーパミン欠乏マウスの解析は、ドーパミンシステムの機能解明において画期的な手法である。ドーパミン欠乏マウスは、ドーパミンの前駆体であるL-DOPAを毎日投与することで長期間維持することができ、従来ではL-DOPA投与24時間後において様々な実験がなされてきた。しかし、研究代表者らはその条件では脳内マイクロダイアリシス法で細胞外ドーパミンを測定するとドーパミンが残存していることを見出し、真のドーパミン欠乏マウスとは言えないことを明らかにした。また、L-DOPA投与3日後では脳内の細胞外ドーパミン量が検出限界以下になることを見出し、この条件では特徴的な行動異常が現れることを見出した。そこで、L-DOPA投与3日後の真のドーパミン欠乏マウスを解析することで、ドーパミンシグナル変調というマイクロエンドフェノタイプが精神活動に与える真の影響を解明できると考え、本研究を着想した。
本研究の具体的な目標は以下である。
1)ドーパミン欠乏時の異常行動に対する定型抗精神病薬(ハロペリドール)、非定型抗精神病薬(クロザピン)の効果を明らかにする。
2)ドーパミン欠乏時の活動を制御する脳領域を同定する。
3)ドーパミン欠乏時に発現変化する遺伝子群を網羅的に同定する。
4)ドーパミン欠乏時の活動を制御する脳内システムを同定する。
5)報酬系を中心とした精神活動におけるドーパミンシグナルの役割を解明する。
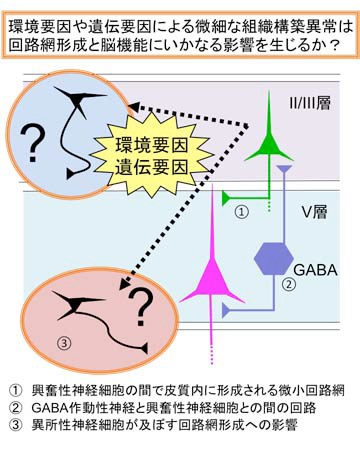
微細な組織構築の異常をマイクロエンドフェノタイプとした精神病態の解明
 久保 健一郎(慶應義塾大学・医学部・解剖学・専任講師)
久保 健一郎(慶應義塾大学・医学部・解剖学・専任講師)
精神疾患の死後脳研究において、神経細胞の配向の異常、層構造の乱れ、異所性の神経細胞など、微細な組織構築の異常がしばしば報告されてきました。これらの所見は統合失調症のみならず、自閉性障害や双極性障害でも報告されており、これらの疾患の神経発達障害仮説を支持する所見として捉えられてきました。一方で、精神疾患多発家系の遺伝学的研究で発見されたDisrupted in schizophrenia1 (Disc1)の発生段階での機能阻害は、大脳新皮質および海馬において、統合失調症患者の脳組織に類似した微細な組織構築の異常を生じます(Kubo K, et al. 2010、Tomita K, et al. 2011)。また、最近、胎児期の代表的な環境要因のいくつかが、マウスの脳に微細な組織構築の異常を生じ、成熟後のマウスの行動に異常に引き起こすことを見いだしました(投稿準備中)。このように、これまでの研究により、遺伝的要因によっても、環境要因によっても微細な組織構築の異常が生じる可能性があることが明らかになりました。それらの遺伝的要因と環境要因は、いずれも統合失調症への罹患率を高めるため、共通の結果として生じる、微細な組織構築の異常は統合失調症のマイクロエンドフェノタイプの候補となると考えられます。しかし、微細な組織構築の異常がどのように疾患発症に結びつくのか、その病態的な意義は明らかではありません。そこで本研究では、それぞれの微細組織構築障害が、どのような回路網形成の異常に結びつき、また、どのような影響を動物の脳機能や行動に及ぼすのかを解明したいと考えております。特に、精神疾患に関連が強い、海馬や前頭前皮質などに注目して、微細組織構築の異常によって、どのような回路網の異常が生じ、それが発達過程においてどのように変化するのかを明らかにしたいと考えております。
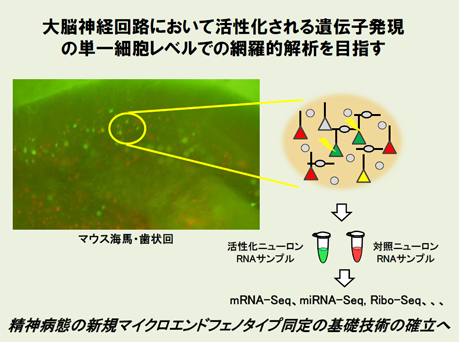
新奇環境認知により活性化される単一ニューロン種のトランスクリプトーム解析
 奥野 浩行(京都大学大学院・医学研究科・メディカルイノベーションセンター・特定准教授)
奥野 浩行(京都大学大学院・医学研究科・メディカルイノベーションセンター・特定准教授)
大脳の認知機能の維持には神経活動依存的な遺伝子発現や蛋白質合成が必要であり、このような細胞遺伝子応答の異常・失調は神経発達障害や精神疾患病態に関連することが示唆されています。特に、外的環境の情報処理や社会的交互作用プロセスに関与する神経ネットワークにおける遺伝子発現応答の全体像を把握することは神経・精神病態の理解に極めて重要だと考えられます。しかしながら、このような神経活動は経験や生活履歴などによる個体差の影響も大きく、これまでのところ遺伝子発現応答の統一的理解には至っていません。また、脳には生化学的・形態的に性質の異なる多種の神経細胞が存在する上、似たようなタイプの神経細胞でも脳の領域・亜領域によっても生理的な性質が異なります。さらに、脳組織には神経細胞以外にもグリア細胞をはじめとする多種多様の細胞が混在しています。このため活動依存的な神経細胞における遺伝子発現を解析するには、対象となる細胞の空間情報を保持したまま、細胞のタイプを特定し、かつ、細胞の活動状態を同定した上でRNAをサンプリングする手法が必要となります。本研究計画では、新奇環境経験によって活性化された大脳・海馬における神経細胞を可視化して同定することにより、脳スライスから実験群と対照群の細胞を単一細胞レベルで採取し、細胞タイプ特異的、活性化ニューロン特異的なトランスクリプトーム解析を行います。本手法が確立すれば、精神疾患病態モデル動物に適用することにより精神病態のマイクロエンドフェノタイプ同定への有効なアプローチ法の一つとなると考えられます。
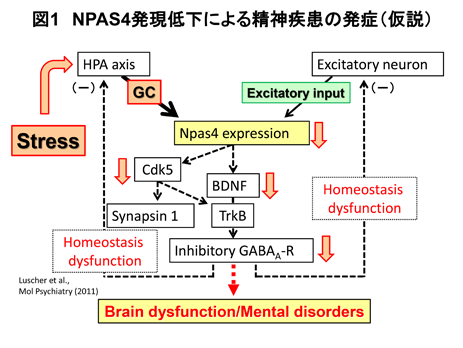
ストレス応答性転写因子NPAS4欠損マウスにおけるGABA神経発達と表現型解析
 山田 清文(名古屋大学・医学部附属病院・教授)
山田 清文(名古屋大学・医学部附属病院・教授)
ストレスが抑制性GABA作動性神経の機能を障害し、その結果、脱抑制により興奮性神経系の活動が亢進することが精神疾患発症の要因の一つと考えられている。ストレス(外的環境要因)がGABA神経系障害(マイクロエンドフェノタイプ)を引き起こす分子機構を解明すれば、ストレスによる精神疾患発症を抑制する治療薬の開発への応用も期待できる。これまでに我々は、1) 幼若期隔離飼育ストレスや拘束ストレスを負荷したマウスでは空間学習記憶や情動行動に異常が生じること、2) ストレスにより海馬の神経新生の障害とGABA神経系発達に関与する転写因子Npas4の遺伝子発現が顕著に低下すること、3) ストレスによって分泌増加するグルココルチコイド(GC)がNpas4の転写を直接抑制すること、4) NPAS4がCdk5の遺伝子発現を誘導し、神経突起伸長を促進することなどを明らかにしている。
GABA神経のシナプス形成や海馬シナプス可塑性にはBDNFが重要であるが、NPAS4はBDNFの転写を促進することが知られている。すなわち、NPAS4は脳のホメオスタシスやシナプス可塑性に関与するストレス応答性の転写因子である。したがって、ストレスによるNPAS4の発現低下は、Cdk5やBDNFなどの発現抑制を介してGABA神経系の機能異常を引き起こし、様々な精神症状の出現に関与している可能性がある(図1)。
本研究では、以下の3項目の実験によりNpas4遺伝子欠損(Npas4-KO)マウスの行動異常におけるGABA神経機能の役割を解析し、ストレス誘発性脳機能障害の発症機構の解明を目指す。
(1) Npas4-KOマウスの行動異常に関連するGABA神経機能の解析
(2) Npas4-KOマウスにおけるGABA神経発達異常の解析
(3) Npas4-KOマウスにおける脳部位特異的Npas4遺伝子レスキューがGABA神経発達に及ぼす影響の解析
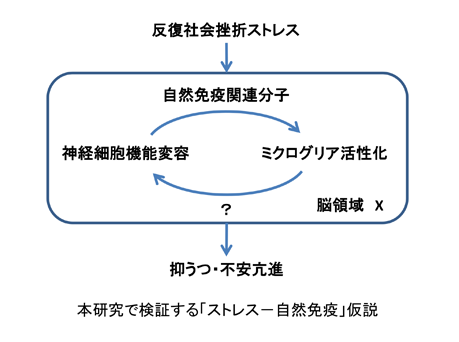
マウス反復ストレスにおける自然免疫関連分子の作用とその活性化機構
 古屋敷 智之(京都大学大学院・医学研究科・メディカルイノベーションセンター ・特定准教授)
古屋敷 智之(京都大学大学院・医学研究科・メディカルイノベーションセンター ・特定准教授)
慢性ストレスや過度のストレスは抑うつや不安亢進といった情動変化を引き起こすと共に、うつ病など精神疾患のリスク因子となる。しかし、ストレスによる脳機能変化の分子・神経回路基盤には不明な点が多く、ストレスを標的とした精神疾患創薬は確立していない。我々は、マウスの反復社会挫折ストレスモデルを用い、ストレスによって前頭前皮質に投射するドパミン系が特異的に活性化すること、ストレスの反復によりこの皮質ドパミン系の活性化が抑制され、これが反復ストレスによる情動変容に必須であることを示した。さらに、反復ストレスによる皮質ドパミン系の抑制には、ストレスによるミクログリア活性化とそれに由来する炎症関連分子が重要であることも示唆している。しかし、ストレスがいかにミクログリアを活性化するか、また活性化されたミクログリアがどこでどのように働くかは不明である。
外来性の病原体の特定の分子群は、一群の自然免疫関連分子を介してマクロファージを活性化し、炎症や免疫応答を惹起する。近年、細胞のストレスや損傷に伴い放出されたダメージ関連分子が、同様の自然免疫関連分子を介して、感染を伴わない炎症・免疫応答を誘導することが知られつつある。本研究では、マウスの反復社会挫折ストレスによるミクログリア活性化と情動変容に自然免疫関連分子群が関与するかを調べ、その脳内での作用点や作用機序を明らかにする。さらにストレスが自然免疫関連分子を活性化するダメージ関連分子も探索する。以上の研究から、反復ストレスによる情動変容における自然免疫関連分子の役割を解明し、精神疾患における新たな創薬標的を提唱したい。
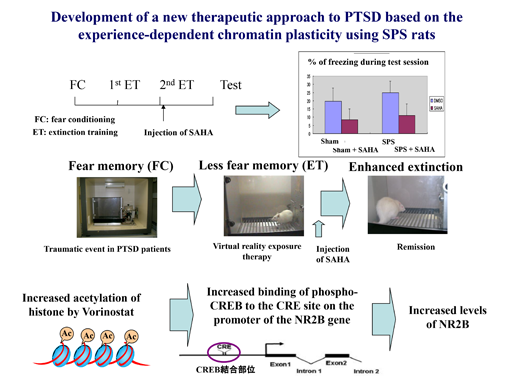
エピジェネティクスと組織化学的手法によるPTSDの病態解明と予防法の開発
 森信 繁(広島大学大学院・医歯薬保健学研究院・精神神経医科学・ストレス脆弱性克服プロジェクト・特任教授)
森信 繁(広島大学大学院・医歯薬保健学研究院・精神神経医科学・ストレス脆弱性克服プロジェクト・特任教授)
【はじめに】
外傷後ストレス障害(PTSD)は重篤なストレスに暴露された結果、恐怖記憶の消去障害(フラッシュバック)・恐怖刺激への回避や麻痺・過覚醒などの症状がみられる疾患であり、その病態は未解明のままである。薬物療法的にはSSRIが有効といわれるも不安・抑うつ症状に効果があるのみで、恐怖記憶の消去障害には認知行動療法(Prolonged exposure法)が用いられているが、長期予後研究から3年予後で約20%の患者が未治の難治性精神障害と位置付けられている。
【本研究に関するこれまでの成果】
我々はこれまでにPTSDの病態解明や新規治療法の開発を目的に、Single prolonged stress (SPS)負荷を用いたPTSDモデルラットの作製を行ってきた。SPSラットは以下のような、PTSD患者が示す臨床症状と極めて類似した特徴をもつことが分かってきた。1) 視床下部-下垂体-副腎皮質機能のenhanced negative feedback、2) Stress-induced analgesia、3) 不安行動の亢進、4) 恐怖記憶の固定化の亢進、5) 恐怖記憶の消去の障害、6) D-cycloserineによる恐怖記憶の消去障害の修復。
【研究計画】
本研究ではPTSDの病態を、重篤なストレス暴露によるグルココルチコイド受容体(GR)情報系の活性化による脳内の遺伝子発現の障害と考え、SPSラットとChIP-Sequencing法を用いて、ストレス暴露によるGRの結合が増大している遺伝子プロモーターをゲノム・ワイドに探索し、PTSDの病態解明を行う。同時にPTSD患者では恐怖記憶の消去障害がみられ、我々のSPSラットを用いた研究から消去訓練中のHistone deacetylase (HDAC)阻害薬の投与が消去障害に著効を示すことを発見しており、HADC阻害薬による治療効果のメカニズムを、組織化学的に解析する計画である。また記憶の固定化に重要な役割を果たす脳由来神経栄養因子(BDNF)による、新たな消去障害の治療法開発を試みる。
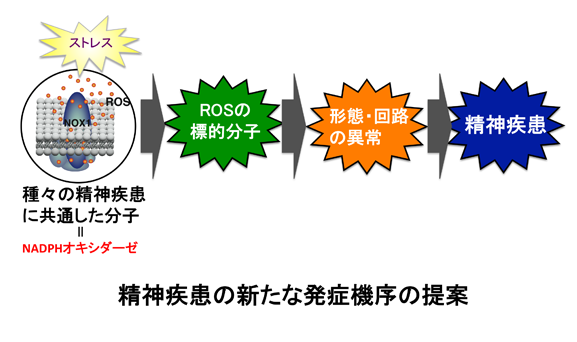
NADPHオキシダーゼを介する精神疾患発症の新しい概念の開拓
 衣斐 督和(京都府立医科大学大学院・医学研究科・助教)
衣斐 督和(京都府立医科大学大学院・医学研究科・助教)
様々な精神疾患の発症に活性酸素種(ROS)による酸化ストレスの関与が示唆されているが、その産生源および酸化ストレスを介した発症機序については未だ明らかになっていない。
ROSの二大産生源としてミトコンドリアと活性酸素産生酵素のNADPHオキシダーゼが位置づけられている。ROSは細胞内機能タンパク(受容体、チャネル、酵素、転写因子など)のSH基のレドックス(酸化還元状態)を変動させ、そのタンパクの活性を制御するシグナル分子として機能する。しかしROS産生量が過剰になると細胞死を惹起する。事実、ミトコンドリア機能不全や、白血球型NADPHオキシダーゼにより過剰産生されるROSは神経細胞死を惹起し、神経変性疾患の発症・進展に寄与する。一方、ROSの関与が示唆される精神疾患では神経細胞死は認められず、神経細胞の構造や機能の変化が認められる。このことはROSが精神疾患発症において神経変性疾患とは異なるメカニズムで関与することが想定される。
新規触媒サブユニットNOX1により構成されるNADPHオキシダーゼはROS産生能が低く、細胞内機能分子のレドックスを制御することで神経機能に作用する。さらに最近、NOX1はストレスによる精神疾患様行動の発現に寄与することを見出した。そこで本研究では「NADPHオキシダーゼを介したレドックス制御」をエンドマイクロフェノタイプに設定し、NOX1欠損動物を用いて、未だ明らかでない課題を解決する。すなわち、
(1)精神疾患におけるNOX1発現機序の解明
(2)NOX1由来ROSによる標的分子の同定
(3)NOX1由来ROSによる神経回路構造や機能への解析
(4)未解析の精神疾患モデルにおけるNOX1の役割
を行い、「精神疾患発症に関わる分子としてのNOX1/NADPHオキシダーゼ」の概念を新たに確立する。
これらを通じて得られた結果より、種々の精神疾患発症に寄与する新たな分子としてROS産生酵素NADPHオキシダーゼを提唱することができ、新たな治療法のシーズを提供することを目指す。
精神ストレスによるマイクロエンドフェノタイプに対するストレスタンパク質の効果
 水島 徹(慶應義塾大学・薬学部・教授)
水島 徹(慶應義塾大学・薬学部・教授)
生体は様々なストレスに対してストレスタンパク質(熱ショックタンパク質(HSP)やスーパーオキシドジスムターゼ(SOD)など)を産生しストレスに対抗している。私は、生体はストレスタンパク質を増やすことにより疾患に対抗しており、このストレスタンパク質の産生が不十分になると疾患が発症・重症化する、即ち、ストレスタンパク質を増やすタイプの医薬品は様々な疾患に有効であるという斬新な仮説を提唱した(本研究提案はこの考えをうつ病へ応用するものである)。そして、アルツハイマー病、小腸潰瘍、特発性肺線維症などの動物モデルにおいて、HSP70が増えていること、及びHSPの産生を増やす薬(誘導薬)を用いてHSP70を増加させると、これら疾患の動物モデルにおいて予防・治療効果が得られることを発見した。また我々は、特発性肺線維症、炎症性腸疾患、COPDの動物モデルにおいて、SOD が増加していることを見いだし、SODのDDS製剤・PC-SODを開発し、この薬がこれら疾患の動物モデルで予防・治療効果を発揮することを見出した。また製薬企業と共同で特発性肺線維症患者に対するPC-SODの第二相臨床試験を行いその有効性を確認した。一方最近我々は、HSP70を過剰発現している遺伝子改変マウスでは、精神ストレスによるうつ病様症状(行動変化など)が抑制されることを見いだした。そこで本研究で我々は、うつ病抑制に働くストレスタンパク質を網羅的に同定しその分子機構を解明すると共に、そのストレスタンパク質を増やす物質を検索し、うつ病治療薬の開発に繋げる。

心的外傷後ストレス障害(PTSD)における記憶情報処理の病態生理
 坂口 昌徳(筑波大学・国際統合睡眠医科学研究機構・准教授)
坂口 昌徳(筑波大学・国際統合睡眠医科学研究機構・准教授)
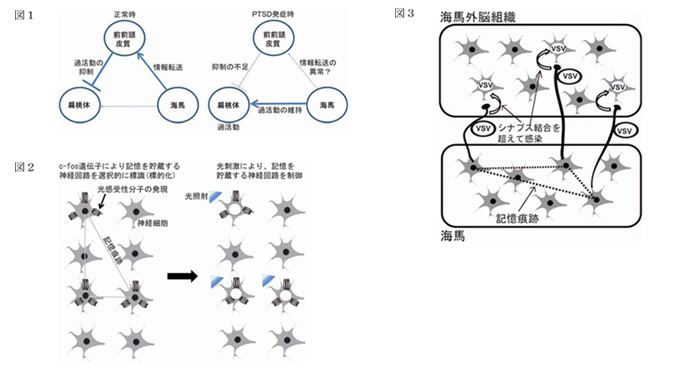
的外傷(トラウマ)記憶などの記憶情報は、海馬で記銘され、記憶が処理されるに伴い前前頭皮質などの海馬外の組織へと転送されることが示唆されている(図1)。一方、心的外傷後ストレス障害(PTSD)は、過剰に強度のトラウマ記憶が処理できず、海馬および前前頭皮質の機能不全が起こり、トラウマ記憶が制御不能になるとされている。結果として、軽微な刺激で扁桃体の過活動が誘発され、フラッシュバックなどにより生じる恐怖反応が長期間持続する(図1右)。このことはすなわち、PTSDの発症において、この記憶の転送メカニズムになんらかの関与があることを示唆する。申請者は新規のマウスPTSDモデルおよび光遺伝学(Optogenetics)技術を確立した。これに、記憶痕跡標的化マウス(図2)および前行性経シナプス神経トレーサーウイルス(VSV:図3)を組み合わせ、記憶痕跡(Engram)を直接観察制御することで、この仮説を検証する。これらの技術は全て領域メンバーに共有され領域の他の研究にも貢献する。本研究の目的は、
目的1.PTSDが記憶の転送に及ぼす影響を明らかにする(遅延することが予想される)
目的2.PTSDにおける記憶転送回路を可視化する(正常な転送経路を形成するか検証)
目的3.PTSDにおいて、海馬および記憶転送先の記憶保持細胞が、どの程度恐怖反応に関与するかを明らかにする(個々の回路を人工的に制御し、恐怖反応への寄与を観察する)
Identifying a microendophenotype of post-traumatic stress disorder
 Joshua Johansen(理化学研究所・脳科学総合研究センター・チームリーダー)
Joshua Johansen(理化学研究所・脳科学総合研究センター・チームリーダー)
Memories make us who we are. Our experiences in the world produce memories by physically changing the brain. Many experiences, like walking down the street to the store on a normal day, we do not remember. However, some memories, such as being attacked by a dog while walking down the street, are burned into our brains and stay with us for our entire lives. What tells the brain to store some experiences as memories while others are forgotten? How does this learning result in adaptive changes in behavior? Answering these questions is a central goal of our laboratory.
Aversive experiences, such as being attacked by a dog, are powerful triggers for memory storage. To accomplish this task, aversive encounters activate neural ‘teaching signal’ circuits which can trigger brain alterations resulting in memory formation.
In the lab we study how teaching signals regulate memory formation and guide adaptive behavior. To study this question we use a variety of aversively motivated behavioral assays including fear conditioning, a powerful model for studying emotional memories. Relative to our knowledge of sensory and motor circuits, we understand very little about the brain mechanisms which translate aversive experiences into neural teaching signals. As a result, there is important work to be done in this research area. Furthermore, the study of aversive teaching signal systems represents an important bridge between multiple areas of neuroscience research. By studying these circuits our ultimate goal is to discover general principles of neural circuit function, neural coding and plasticity as they relate to adaptive behavior. These insights may ultimately guide us toward a better mechanistic understanding of learning and memory, decision making, pain, emotion and many other aspects of human experience.
Dysfunction in aversive teaching signal circuits may underlie some of the clinical pathology associated with chronic pain and anxiety disorders. Understanding the mechanisms of aversive teaching signal circuits could also facilitate the development of novel treatments for these debilitating conditions.