計画研究では、統合失調症、うつ病、双極性障害、心的外傷後ストレス障害(PTSD)などの精神疾患に着目し、ヒト由来試料(iPS細胞と死後脳)と、ゲノム要因と環境要因を再現した動物モデルを用いて、各精神疾患に特異的及び共通するマイクロエンドフェノタイプを同定します。具体的には、患者とモデル動物に共通するシナプス伝達及び神経回路の障害、神経突起及びシナプス形態異常、さらに、細胞内・細胞間情報伝達の障害を見出し、精神病態のマイクロエンドフェノタイプを抽出します。そして、モデル動物・細胞を用いて、マイクロエンドフェノタイプの分子基盤・病態機序を分子細胞生物学的に解明します。さらに、精神疾患患者由来iPS細胞を用いた研究と死後脳研究を組み合わせて、同定されたマイクロエンドフェノタイプの妥当性を検証します。
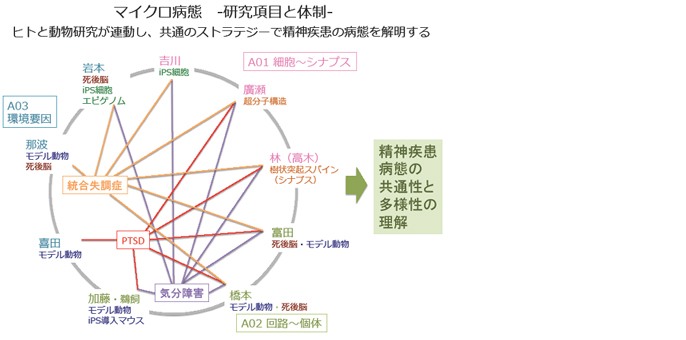
研究項目として、ゲノム要因によるマイクロエンドフェノタイプの同定・解析を細胞・シナプスレベルで目指す研究項目A01と、回路・個体レベルで目指すA02、さらに、環境要因により病態を表出するマイクロエンドフェノタイプの同定・解析を目指すA03を設定しました。本領域の特色として、各計画研究がそれぞれ単独で研究を進めるわけではなく、気分障害、統合失調症、PTSDといった精神疾患に関して、モデル動物とヒトを対象とする研究、また、革新的技術を開発し活用する研究が連携しながら研究を進める体制をとっています。さらに、全計画研究を合わせると、ゲノム・環境要因をそれぞれ対象とする研究、ヒトと動物をそれぞれ対象とする研究、ヒトと動物をつなぐ研究が分子・細胞・シナプス・回路レベルで、連動しつつ進展することになります。全ての計画研究が同時進展することで、精神疾患のマイクロエンドフェノタイプの共通性と多様性が理解できるようになります。また、マイクロエンドフェノタイプの同定と解析には、シナプスを標的として光操作するSynaptic-optogenetics、また、STORM/STED顕微鏡を用いた超分子イメージングなど、斬新な手法を開発しながら活用します。
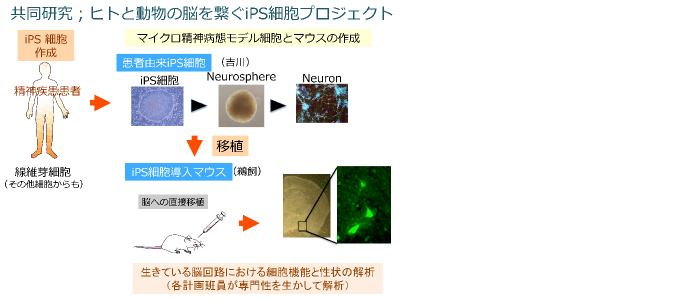
さらに、計画班員間の共同プロジェクトとして、患者由来iPS細胞を脳内に導入したマイクロ精神病態モデルマウスの開発を試みます。iPS由来細胞をマウス脳内に導入する方法を開発し、計画班員が各自の専門性を生かして共同解析を進め、iPS細胞導入マウスの精神疾患モデルマウスとしての有用性を評価します。
細胞及びシナプス機能・形態、細胞内外分子動態・分子間相互作用、遺伝子発現制御機構、細胞内情報伝達機構などを対象として、分子動態・細胞・シナプスレベルのマイクロエンドフェノタイプの同定とその解析を試みます。

統合失調症由来iPS細胞を用いた病態関連分子・細胞基盤の解明
 吉川 武男 (理化学研究所・脳科学総合研究センター・チームリーダー)
吉川 武男 (理化学研究所・脳科学総合研究センター・チームリーダー)
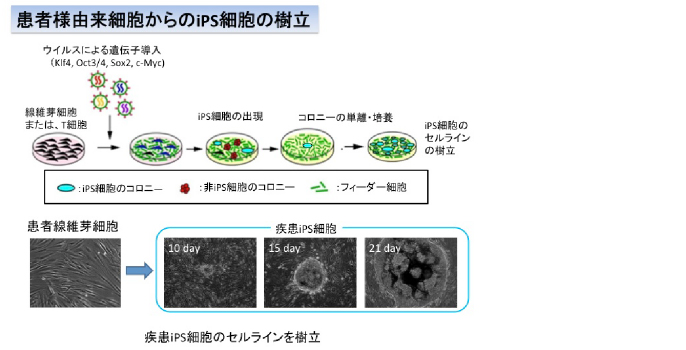
統合失調症の発症脆弱性基盤として「神経発達障害仮説」が有力であるが、これまではヒト由来サンプルを用いて当該仮説に直接アプローチできる方法論がなかった。よって、どのような「神経発達障害」が素地となって、思春期以降の顕在発症に繋がるのかは、全くブラックボックスであった。そこで我々は罹患者からiPS細胞を作製して、神経発達最初期の異常やその後の分化過程・シナプス形成の異常を実際のヒト神経細胞で捉えることによって、「神経発達障害仮説」の具体的事象の解明、分子・細胞病理の新しいパラダイムの発見に挑む。疾患対象者として、ゲノムに大きな変異(コピー数多型)のあるサンプルや遺伝子にナンセンス変異やフレームシフトを持つサンプルを積極的に収集して、原因異質性の高い統合失調症の中でも「切り口」のある症例に重点を置き、病態と関連する「マイクロエンドフェノタイプ」レベルの表現型を観察できる可能性を高める。最初はオミックス解析(RNA、蛋白、脂質)から始め、分子として病理の特異点および収束点の同定を視野に入れる。次段階として、対照群と疾患群で神経系細胞の発生・分化の様体の差異の検出に注力する。統合失調症ではオリゴデンドロサイトやGABA介在ニューロンの機能障害が指摘されている。その他、AMPA受容体の動態や、シナプス分子の構造的動態も近年注目されている。iPS細胞から分化させた各種神経細胞集団を用いて、上記の問題点にアプローチする。第3段階として、統合失調症に関連のある分子・細胞・微細構造レベルの異常を検出した後、それらをどのように回復させることができるかに挑む。この段階では、分子の網羅的解析から得られた情報だけではなく、現在行っている「統合失調症の予防に有用な母乳成分の研究」から得られた化合物や、モデル動物の解析から得られた候補物質もテストする。なお、研究期間を通してiPS細胞サンプルの拡充に努め、かつ樹立したiPS細胞は本研究班以外の研究者にも提供し、さまざまな解析に使用してもらうと共に、バンクに供与し広く科学コミュニティに活用してもらう。

精神疾患マイクロエンドフェノタイプとしての樹状突起スパインの解析
 林(高木)朗子 (東京大学大学院・医学系研究科・助教)
林(高木)朗子 (東京大学大学院・医学系研究科・助教)
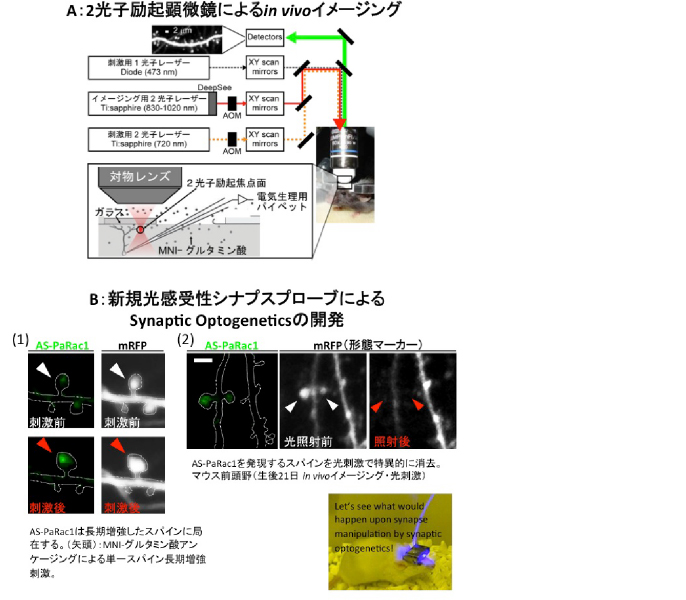
シナプスは神経回路の最小単位であり、その適切な形成および可塑性が正常な神経回路の基盤である。様々な精神疾患に、グルタミン酸作動性シナプスの関与が強く示唆されるものの、どのような病態がシナプスレベルで進行していくのかは未解明である。グルタミン酸作動性シナプスの約7割は、樹状突起上に小突起構造(スパイン)を形成する。スパインは、形態と機能に著しい相関性があり、形態をイメージングするだけでそのシナプス機能を精度良く推測できるという方法論的な大きな利点がある。即ち、様々な疾患関連モデルを、2光子顕微鏡によりin vivoで繰り返しイメージングすること、Optogeneticsによってスパイン形態を人為的に操作すること、これら同一個体に行動解析を併用し、スパイン形態と精神疾患様異常行動との関連を模索することが可能になりつつある。
【戦略1:疾患モデルマウスの縦断的in vivoシナプスイメージング】
表面的・構成的・予測的妥当性を満たす有力な疾患モデルマウスの異常行動発症前後でシナプスイメージングを行い、行動解析を併用する。これらを通じて、シナプスと行動との関連や、新規治療薬候補化合物の効果測定に耐えうるモデルシステムを確立する。
【戦略2:新規光刺激法Synaptic Optogeneticsの確立】
長期増強したスパインを特異的に退縮させる新規光感受性シナプスプローブActivated Synapse targeting PaRac1(AS-PaRac1)の開発に成功している。この新規プローブと疾患関連プロトコールを組み合わせたシナプスマッピングにより病態関連回路を可視化すること、さらにマッピングされたスパインを光刺激特異的に退縮させ、ある特定のスパイン群を人為的に書き換えることで如何なる行動変化が誘発されるか検証する(Synaptic Optogenetics)。
【戦略3:患者由来iPS細胞のin vivo 2光子顕微鏡イメージング】
領域内連携で作製された患者由来iPS細胞移植マウスのスパイン形態可塑性を検証する。in vivoイメージン後は、single cell transcriptome解析を行い、生体脳における患者由来iPS細胞の性質を調べつくす。精神疾患は単一遺伝でなく多因子遺伝性であるため、患者遺伝情報のほとんどを包括するiPSを生体脳に近い状態で観察することは、少数の遺伝子変異に基づいたモデル動物研究では見出せない重要知見を得られる可能性がある。
上記3つの相補的戦略により、スパインと精神疾患様行動との関連性に挑戦し、さらには、疾患マイクロエンドフェノタイプとしてのスパイン概念および疾患病態解明を試みる。

精神疾患におけるシナプス超分子構造機能連関の変容
 廣瀬 謙造 (東京大学大学院・医学系研究科・教授)
廣瀬 謙造 (東京大学大学院・医学系研究科・教授)
精神疾患の分子メカニズムの解明においては、シナプスに局在する分子(シナプス分子)の欠損や変異などに起因するシナプス機能の変容を理解することが重要であると考えられるようになってきました。さらに、近年、シナプス分子のナノ〜マイクロメートルレベルでの空間配置(超分子構造)の変容と精神疾患との関連の重要性を示唆する報告がなされており、シナプス機能とシナプスでの超分子構造の変容に着目した精神疾患の病態メカニズム理解への期待が高まっています。本研究では、統合失調症患者のシナプスで生じている超分子構造の変容をマイクロエンドフェノタイプとして同定・解析することで、統合失調症の病態メカニズムを解明することを目的とします。また、領域内の連携によって、複数種の精神疾患での超分子構造の変容の普遍性と多様性についても明らかにすることを目指しています。本研究では、シナプス分子の超分子構造とシナプス機能を直接的に対応付けた解析を実現するために、多様なアプリケーションに対応できる高性能超解像顕微鏡システムを軸とするマイクロエンドフェノタイプの観察・解析システムの開発を行います。このシステムを駆使してナノレベルの解像度でのシナプス分子の空間配置の測定を実現し、シナプス機能との定量的な対応付けをする方法論の確立を目指します。この方法論を用いることによって、統合失調症モデルマウスの標本でシナプス分子の超分子構造とシナプス機能との連関の変容を明らかにします。また、モデル動物で見られたシナプス分子の超分子構造の変容がヒトの統合失調症患者由来の標本においても見られるのかどうかを評価し、最終的にシナプスで見られる超分子構造の変容を精神疾患のマイクロエンドフェノタイプとして確立します。さらに、領域内での連携によって、双極性障害、心的外傷後ストレス障害(PTSD)などのモデル動物での超分子構造の変容の解析を行い、精神疾患を通じての超分子構造の変容の普遍性と特異性について明らかにします。
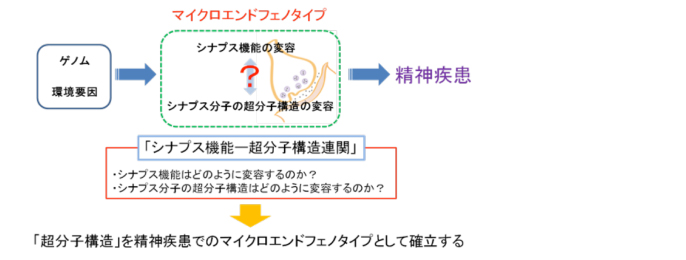
ニューロン間相互作用、領野内及び領野にまたがる神経回路の機能的変化及び再編、ニューロン集団の機能・性状などを対象として、個体内の神経回路を中心にマイクロエンドフェノタイプの同定とその解析を試みます。

双極性障害の原因神経回路の解明
 加藤 忠史 (理化学研究所・脳科学総合研究センター・チームリーダー)
加藤 忠史 (理化学研究所・脳科学総合研究センター・チームリーダー)
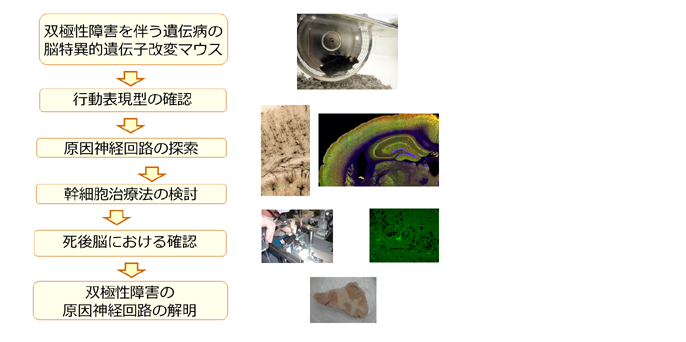
本計画研究では、二大精神疾患の一つである双極性障害(躁うつ病)の原因解明を目指す。双極性障害は、躁状態とうつ状態を反復することにより、社会的後遺症を来す疾患であり、気分安定薬などの有効性が知られているが、副作用や効果が不十分なことから、再発を繰り返す患者が多く、根本的治療法の開発が待たれる。また、双極性うつ病では、抗うつ薬の有効性が乏しく、悪化のリスクもあることが知られているが、現状では、病歴聴取を含めた面接による診断法に頼っており、初発のうつ状態では原理的に診断ができないため、早期診断法の開発が望まれている。
これまで、双極性障害の研究は、ゲノム研究と脳画像研究が中心であり、その間の神経細胞および神経回路レベルの病態についてはほとんどわかっていなかった。本研究では、こうしたレベルでの病態であるマイクロエンドフェノタイプを、動物モデルを用いて同定し、これを患者死後脳で確認する。こうした知見が得られれば、診断法、治療法の開発にもつながると期待される。
我々はこれまで、双極性障害患者の磁気共鳴スペクトロスコピーにより、ミトコンドリア病に類似した脳エネルギー代謝障害を見いだすと共に、気分障害を伴うことのあるまれな遺伝性疾患、慢性進行性外眼筋麻痺(CPEO)と同様に脳内に変異ミトコンドリアDNAが蓄積していることを示した。そこで、CPEOの原因遺伝子(Polg)の変異体を脳だけに発現させた遺伝子改変マウスを作成し、双極性障害様の行動変化を呈することを報告した。
本研究では、双極性障害のマイクロエンドフェノタイプを明らかにするため、このマウスの行動変化を引き起こす神経回路病態を明らかにする。まずは、異常ミトコンドリアDNA(mtDNA)が蓄積している細胞を免疫組織化学的に可視化し、ハイスループットな形態解析を行い、異常な細胞が蓄積している脳部位を特定する。さらに、他の計画班と連携して、スパイン形態の変化について、多角的に形態解析を進める。
また、神経回路遺伝学的手法を用いて、原因神経回路に特異的な機能的ノックダウンを行った後、行動解析を行い、これらの神経回路が行動異常の原因かどうかを検証する。
また、神経幹細胞移植による神経回路修復による治療の可能性を検証するため、このマウスに神経幹細胞移植を行い、その生着部位と行動異常改善の観察を行なう。

グルタミン酸シグナルを介した精神疾患病態に関するマイクロエンドフェノタイプの解明
 橋本 謙二 (千葉大学・社会精神保健教育研究センタ−・教授)
橋本 謙二 (千葉大学・社会精神保健教育研究センタ−・教授)
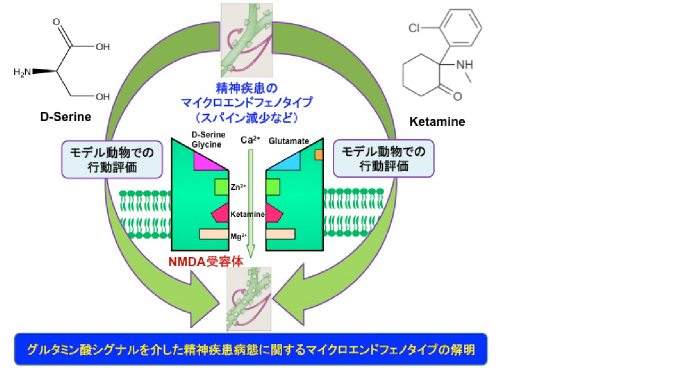
興奮性アミノ酸の一つであるグルタミン酸を介する神経伝達は、統合失調症、気分障害(うつ病、双極性障害)、不安障害などの精神疾患の病態(マイクロエンドフェノタイプ)において重要な役割を果たしている。精神疾患のマイクロエンドフェノタイプのうち、最も研究が進んでいるのは、うつ病における樹状突起委縮およびスパインの減少であるが、その基盤となる分子動態は不明であり、これに対する治療薬の作用メカニズムも不明である。近年、グルタミン酸受容体のサブタイプの一つであるNMDA受容体拮抗薬ケタミンが、治療抵抗性のうつ病患者および双極性障害患者に対して、単回投与で即効性抗うつ効果を示すことが報告され、治療抵抗性うつ病の病態におけるNMDA受容体を介するグルタミン酸神経伝達系が注目されている。
一方、ヒトを含む哺乳類の脳に高濃度に存在しNMDA受容体の内在性アゴニストとして興奮性神経伝達に重要な役割を担うD型セリンが、高次脳機能だけでなく、精神疾患の病態にも深く関わっていることが示されている。グリシンおよびD型セリンは、NMDA受容体のグリシン調節部位の内在性アゴニストとして、古くから知られている。最近、D型セリンはsynaptic NMDA受容体のアゴニストとして作用するのに対して、グリシンはextrasynaptic NMDA受容体のアゴニストとして作用することがCELL誌に報告された。さらに、D型セリンの誘導体であるD型サイクロセリンは、統合失調症の治療薬としての可能性も報告されている。またD型サイクロセリンは、心的外傷後ストレス障害(PTSD)、パニック障害、強迫性障害、社会不安障害などの多くの不安障害に対する認知行動療法との併用による有効性が注目されている。
本研究の目的は、代表的な精神疾患であるうつ病のマイクロエンドフェノタイプであるスパイン減少に対するケタミン等のグルタミン酸神経系薬剤の作用メカニズムを解析する。さらに、精神疾患のマイクロンドフェノタイプとしてのD型セリンの脳内分子動態変化を明らかにする。

精神神経免疫相関が関与する精神疾患病態のマイクロエンドフェノタイプの解明
 富田 博秋 (東北大学・災害科学国際研究所・教授)
富田 博秋 (東北大学・災害科学国際研究所・教授)
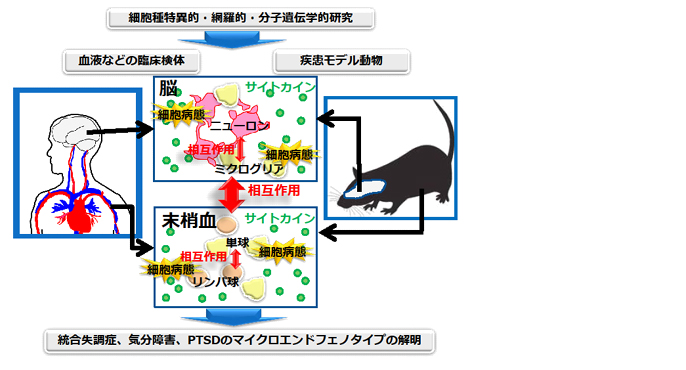
従来から精神疾患罹患者の末梢血液中の特定のサイトカインの濃度や死後脳組織の活性化ミクログリアの数に異常がみられることから、免疫と脳神経機能や精神活動との相関、すなわち、精神神経免疫相関現象が精神疾患病態に関与していることが示唆されていますが、精神疾患罹患者の末梢免疫細胞やミクログリアで何が起きているのかについてはよく分かっていません。一方、近年、精神疾患罹患者と健常対象者から採取した末梢血液検体の網羅的分子遺伝学的解析がなされるようになりましたが、血液は様々な種類の細胞の構成比率は人により、採血時の状態により様々ですので、血液総体でみた現象がどの細胞の変化を反映しているか判然とせず、また、血液での変化が中枢神経病態の何を反映しているかも分かり難いという問題があります。本申請研究では精神疾患罹患者の血液中の特定の免疫細胞の病態を特定するとともに、免疫細胞の病態変化が中枢神経病態や行動とどのように関連しているかを死後脳やモデル動物を対象とする研究で明らかにすることを目指します。具体的には下記3つのアプローチによる研究の知見を統合することで、精神神経免疫相関機構を介して精神疾患の病態形成と回復過程に関わる関わる脳内細胞と免疫細胞のマイクロエンドフェノタイプを特定するとともに、本研究により明らかとなるマイクロエンドフェノタイプを利用した精神病態の新規診断方法や治療法の開発を目指します。
1)統合失調症、気分障害、PTSDなどの罹患者と健常対象者の血液や唾液の単球やヘルパーT細胞などの免疫細胞を単離して、貪食能、補体やサイトカインの産生能などの機能を評価するとともに、網羅的な遺伝子発現解析などによって分子遺伝学的性状を解析し、病態の形成・持続や回復過程に関係する因子を特定します。
2)PTSDモデルとしてA03喜田が開発したマウス恐怖記憶解析系などのモデルマウスを対象に、末梢の免疫細胞での現象と脳内ミクログリア、神経細胞や神経回路、脳の形態・機能、行動などに起こる現象の双方を解析し、相関、因果関係を調べることで、免疫細胞の機能変化が精神疾患の病態形成や回復を促進する精神神経免疫相関のメカニズムを明らかにします。
3)統合失調症、気分障害などの死後脳研究を行い、精神疾患罹患者の脳内ミクログリアや脳組織で起こっていることを検証します。
心理的ストレス、周産期障害、養育環境、生物リズムなどの外的刺激によって誘導される分子動態・細胞・回路レベルのマイクロエンドフェノタイプの同定とその解析を試みます。

環境要因が導く精神疾患モデルを用いたマイクロエンドフェノタイプ同定と分子基盤解明
 喜田 聡 (東京農業大学・応用生物科学部・教授)
喜田 聡 (東京農業大学・応用生物科学部・教授)
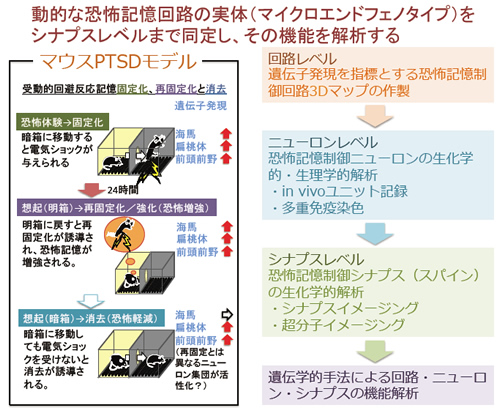
心理的ストレス(恐怖体験)を中心とした環境要因によって精神病態を誘導するマイクロエンドフェノタイプを同定し、さらに、その制御基盤を解明する。恐怖体験(恐怖記憶)後に発症する心的外傷後ストレス障害(PTSD)の原因は動物からヒトにまで保存された恐怖記憶制御の破綻であると理解されている。特に、恐怖記憶想起後に誘導される再固定化と消去がPTSD発症の鍵を握るプロセス群として注目されている。従って、PTSDの治療法開発には、恐怖記憶制御の核となるマイクロエンドフェノタイプの同定とその制御基盤の解明が必要不可欠である。しかし、現在、特定脳領野において恐怖記憶を制御するニューロンの生理学的同定が進められているものの、可塑的変化を誘導する分子レベルの変化を指標として、想起後の恐怖記憶制御回路を網羅的に同定し、回路・ニューロン・スパインの機能を個体レベルで解析する試みは皆無である。さらに、世界的に見ても、再固定化と消去時の回路・細胞・シナプス・分子レベルの作動原理が不明のまま、基礎研究の成果が臨床応用されているのが現状である。一方、私のグループでは、現在までに、恐怖記憶回路制御遺伝子群を同定し、恐怖記憶回路は多領野にまたがっていることを明らかにした。さらに、最も重要な点として、恐怖記憶回路は想起後にダイナミックに変動すること、すなわち、動的な恐怖記憶回路の存在を示してきた。そこで、本研究では、我々が開発した独自のマウス行動実験系を用いて、最新イメージング・分子・光遺伝学的手法により、領野にまたがる恐怖記憶制御回路を細胞・シナプスレベルまで網羅的に可視化し、その性状を生化学・生理学的に解析し、さらに、その機能を解析する。以上の研究を通して、動的な恐怖記憶回路の実体(マイクロエンドフェノタイプ)の解明を試みる。また、環境要因が誘導するタイプの新規精神疾患病態モデルマウスの開発も試みる。
具体的な研究項目は以下の通りである。
(1) 可視化による恐怖記憶制御回路・ニューロン・スパインの同定
(2) 可視化による恐怖記憶制御回路・ニューロン・スパインの性状解析
(3) 遺伝学的手法、生理学的手法を用いた恐怖記憶制御回路・ニューロン・スパインの機能解析
(4) 環境要因による精神疾患病態モデルマウスの開発と解析

精神疾患患者死後脳における神経細胞ゲノム動態の解析
 岩本 和也 (東京大学大学院・医学系研究科・分子精神医学講座・特任准教授)
岩本 和也 (東京大学大学院・医学系研究科・分子精神医学講座・特任准教授)
主要な精神疾患である統合失調症や気分障害では、これまで血液や唾液といった末梢試料由来のゲノムDNAを用い遺伝学的解析が多く行われてきた。しかしながら、病因の大部分は未だ不明であり、近年の大規模多施設ゲノムワイド関連研究においても効果の小さな遺伝要因が明らかにされているのみである。
脳神経系のゲノムDNAは、個体内外の環境要因の影響を受けてエピジェネティックな修飾状態が変動するほか、トランスポゾンの転移パターンや染色体異数性、染色体微小欠失など複数の独立した機構により、体細胞ゲノム変異の蓄積が起きていることが明らかにされつつある。脳神経系ゲノムの動的特性と多型性は末梢ゲノムと大きく異なることが予想され、頻度やパターンの変化が精神疾患の病因・病態に深く関わっていることが想定される。
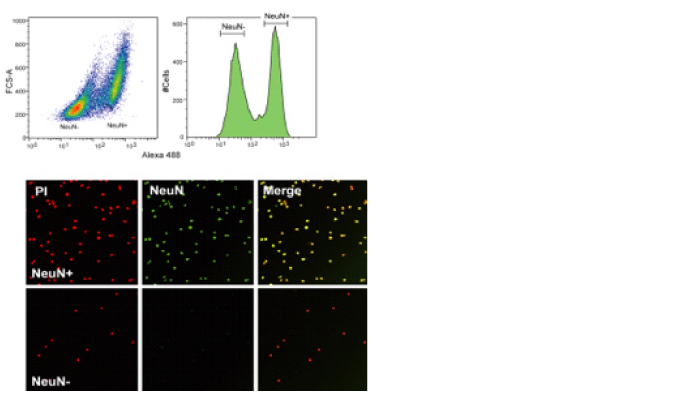
本研究計画では「神経細胞におけるゲノム動態」をマイクロエンドフェノタイプとしてとらえ、主に統合失調症患者死後脳組織から単離した神経細胞・非神経細胞(図1)を用いてエピジェネティックな修飾状態を明らかにするとともに、トランスポゾン挿入部位を中心とした体細胞ゲノム変異の探索を行う。また、iPS細胞及びiPS導入精神疾患動物モデルを利用し、神経細胞ゲノム動態に異常が生じているかどうかの検討を行い因果関係の検証を行う。
図1. ヒト死後脳試料での神経核(NeuN+)分離。セルソーターのプロファイル(上段)。顕微鏡観察による確認(下段)(Iwamoto et al., 2011 Genome Res)

精神疾患においてサイトカインがもたらす神経エンドフェノタイプの変換と病態
 那波 宏之 (新潟大学・脳研究所・教授)
那波 宏之 (新潟大学・脳研究所・教授)
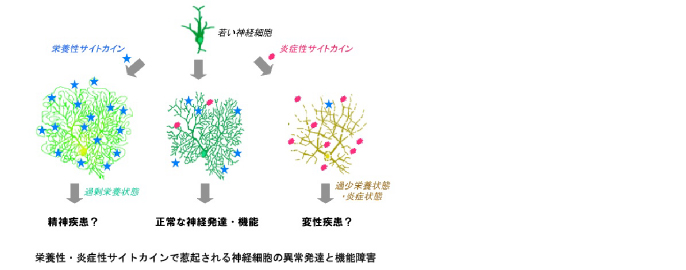
サイトカインは、旧来は狭義に、免疫システムにおける細胞間分化因子を指していたが、近年はより広義に捉えられるようになり、脳神経系における神経栄養因子や成長因子をも含むようになった。脳神経系においてこれらサイトカインは、ニューレグリン1(NRG1)などの栄養性サイトカイン(神経栄養因子)とインタロイキン1(IL-1)などの炎症性サイトカインとに大別できる。いずれも正常な脳神経発達を支える調節因子であるが、その過剰なシグナルは精神病態をヒトで惹起し、動物では認知行動異常を誘発する。最近では、神経発達障害関連疾患(統合失調症や自閉症)の発症における外部環境の媒介因子ではないかと、その重要性が指摘されている。しかし、その細胞・回路レベルでのサイトカインによる脳内病態変化はほとんど解明・可視化されていない。実際、モデル動物研究や患者臨床研究により、サイトカインと精神病態・行動変化(エンドフェノタイプ)は密接に相関していることがわかっているが、具体的に脳内神経回路で何が起きているか(マイクロエンドフェノタイプ)は、いまだ把握しきれていない。本研究では、サイトカイン投与・遺伝子改変等により樹立された統合失調症を代表とする各種精神疾患のモデル動物を用いて、脳内神経回路、とくにモノアミン神経回路の構造異常と機能変化の実態を把握したい。その上で患者死後脳変化と対比・考察し、当該精神疾患のマイクロエンドフェノタイプを明らかにする計画である。このように精神疾患関連するサイトカインシグナルの標的と実態を解明することで、新たな治療法のシーズも得ることが期待される。
精神疾患患者由来iPS細胞を脳内に導入したマイクロ精神病態モデルマウスの開発
本領域では、精神疾患研究におけるヒト生体試料の少なさを補うため、精神疾患患者由来のiPS細胞やiN細胞を作製します。これら細胞株が、死後脳と並び、精神疾患の貴重な生体試料としての役割を果たします。さらに、これら細胞株を培養細胞レベルで解析するにとどまらず、患者由来iPS細胞をマウス脳内に導入し、マイクロ精神病態モデルマウスの開発を試み、脳内に導入されたiPS細胞の機能を個体内で評価します。このiPS細胞プロジェクトは、領域内の計画班員間の共同研究として遂行し、それぞれの計画研究代表者が専門とする技術を用いて解析し、新しいタイプの精神疾患モデルマウスとしての有用性を評価します。iPS導入マウスの作製は計画研究の分担研究者鵜飼渉(札幌医科大学・医学部・講師)によって行われます。